Как изменится работа медорганизаций с введением обязательной маркировки лп
Содержание:
Роль Регистратора выбытия
Второй раз клинике придется выгружать информацию во время использования препаратов или при их перемещении между отделениями. При использовании лекарств отправляемый в систему документ должен содержать указания на законодательные и/или установленные внутренними правилами основания для этого. В документе «Паспорта процессов, автоматизированные в ИС МДЛП» отражено, что можно выгружать информацию об использовании лекарств в первичной и вторичной упаковках. Но в рамках эксперимента маркируется только вторичная. Выгрузка информации о передаче лекарства для медицинского применения означает, что оно выбыло из оборота.
В требованиях к организации процесса выбытия прописано, что он должен проходить с обязательным применением специального прибора – «Регистратора выбытия». Речь о небольшом электронном устройстве с экраном, клавиатурой, встроенным сканером маркировки и несколькими разъемами для подключения к компьютеру или локальной сети. Работа с Регистратором начинается с создания накладной, акта списания или другого подобного документа со списком выбывающих препаратов. После создания документов нужно просканировать коды маркировки препаратов из списка. Подключение устройства к компьютеру позволяет сразу видеть результаты сканирования на экране. В противном случае сканирование происходит вслепую.
Для отправки информации в систему мониторинга с помощью Регистратора нужно еще внести номер и дату документа-основания выбытия. При интеграции устройства с информационной системой клиники вводить номера документов вручную не придется. Подключение Регистратора выбытия к локальной сети позволяет работать с ним сразу с нескольких компьютеров. При этом пользоваться встроенным сканером не получится. Вместо него можно будет использовать обычные сканеры штрих-кодов, подключенные к компьютеру. Но информация о выбытии будет отправляться с помощью Регистратора. Такой вариант подходит для крупных клиник и медицинских центров, так как у них, скорее всего, уже есть компьютеры и сканеры на рабочих местах.
 Примерный внешний вид Регистратора выбытия, окончательный вариант пока не утвержден.
Примерный внешний вид Регистратора выбытия, окончательный вариант пока не утвержден.
Оператор системы должен предоставлять Регистратор выбытия за свой счет. Для получения устройства необходимо оформить запрос в разделе «Анкеты и договоры» личного кабинета. Перед оформлением запроса нужно ознакомиться с проектом договора на оснащение. После остается выбрать место деятельности, заполнить анкету на получение и дождаться результата ее рассмотрения.
Пока маркировка не станет обязательной, регистратор выдается только клиникам, которые участвуют в тестировании системы.
Условия поддержки
Методическую поддержку пользователей в сервисе выполняет партнер «1С», который подключил пользователя к приложению. Также доступна линия консультаций продукта по адресу med@1c.ru.
Обращения, связанные с доступностью сервиса, линия консультаций сервиса фирмы «1С» принимает в режиме 24/7 от пользователей и партнеров по адресу support@1cfresh.com.
Партнёры могут оказывать пользователю услуги за дополнительную плату. Список услуг и стоимость определяется партнером и пользователем по согласованию сторон. Примеры услуг:
- проведение начального дистанционного обучения приёмам работы;
- консультации по подключению штрихкод сканеров или терминалов сбора данных;
- переход облачного приложения «1С:МДЛП» на учёт в специализированном решении, например, «1С:Медицина. Больничная аптека» с переносом данных;
- настройка приложения под нужды пользователя;
- «Личный консультант» — персональные консультации по вопросам работы на информационной базе пользователя.
Условия использования
Платные тарифы делятся по сроку — 3, 6 или 12 мес.
Чтобы работать в приложении «1С:МДЛП» после тестового периода на платной основе пользователям предлагаются тарифы на выбор
| Номенклатура | Рекомендованная розничная с НДС, ₽ |
|---|---|
| 1С:МДЛП 3 мес. | 2500 |
| 1С:МДЛП 6 мес. | 5000 |
| 1С:МДЛП 12 мес. | 10 000 |
| 1С:МДЛП Дополнительный сеанс 3 мес. | 2500 |
| 1С:МДЛП Дополнительный сеанс 6 мес. | 5000 |
| 1С:МДЛП Дополнительный сеанс 12 мес. | 10 000 |
Тариф «1С:МДЛП» включает:
- доступ к приложению «1С:МДЛП»,
- 1 информационная база для реальной работы,
- 1 информационная база для тестирования;
- 2 доступных сеанса, или одновременно открытых окна браузера,
- 1 пользователь,
- подключение дополнительных сеансов без ограничений (расширение количества одновременно работающих пользователей производится подключением необходимого количества тарифов «1С:МДЛП Дополнительный сеанс»),
- доступ к информационной системе 1С:ИТС уровня ТЕХНО.
Корректировка или отмена оформленной подписки на тариф невозможна.
Коробочной версии приложения нет. Апгрейды и переход с других тарифов не предусмотрены. Перенос данных из других конфигураций не предусмотрен.
Поддержка
Методическую поддержку пользователей выполняет партнер «1С», который подключил пользователя к приложению. Также доступна линия консультаций продукта по адресу med@1c.ru.
Обращения, связанные с доступностью сервиса, линия консультаций сервиса фирмы «1С» принимает в режиме 24×7 от пользователей и партнеров по адресу support@1cfresh.com.
Партнеры могут оказывать пользователю услуги за дополнительную плату. Список услуг и стоимость определяется партнером и пользователем по согласованию сторон. Примеры услуг:
- проведение начального дистанционного обучения приемам работы;
- консультации по подключению штрихкод сканеров или терминалов сбора данных;
- переход облачного приложения «1С:МДЛП» на учет в специализированном решении, например, «1С:Медицина. Больничная аптека» с переносом данных;
- настройка приложения под нужды пользователя;
- персональные консультации по вопросам работы информационной системы пользователя.
Усиленная квалифицированная электронная подпись
Для подключения к личному кабинету необходима усиленная квалифицированная электронная подпись (УКЭП), оформленная на руководителя организации. В качестве квалифицированного сертификата электронной подписи организации рекомендуем использовать сертификат, полученный с помощью сервиса 1С:Подпись.
Для поддержки работы с квалифицированными сертификатами необходимо получить и установить на персональный компьютер актуальную версию криптопровайдера. Поддерживается работа со следующими программами:
- ViPNet CSP;
- КриптоПро CSP.
Оборудование для считывания средств идентификации
Считывание средств идентификации лекарственного препарата (двумерных штрихкодов) требуется в двух случаях:
- при регистрации приемки товаров;
- при регистрации вывода лекарственных препаратов из оборота непосредственно в подразделениях (отделениях) медицинской организации (по решению главного врача и при наличии сетевого подключения к регистратору выбытия, установленному в локальной сети медицинской организации).
Смартфон в качестве терминала сбора данных
Использование смартфона позволит отказаться от покупки штрих-код сканеров или терминалов сбора данных и начать работу с ФГИС МДЛП сразу после подключения к «1С:МДЛП».
Мобильные приложения:
для Android — «Сканер МДЛП» (ООО НПФ «Форус», 1cfresh@forus.ru).
Оборудование
Для считывания штрихкодов может применяться оборудование, поддерживающие считывания Data Matrix и поддерживаемое «1С:Библиотекой подключаемого оборудования»:
- штрихкод-сканеры;
-
терминалы сбора данных (ТСД).
Драйвер ТСД должен соответствовать «Требованиям к разработке драйверов подключаемого оборудования» версии 2.5 и выше.
Рекомендуемое оборудование:
- Сканер штрихкода 1С 2200 2D;
- ТСД Urovo i6300 2D;
- ТСД Urovo i6200 2D.
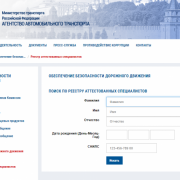
Общее описание системы и участники проекта
Разрабатываемая система призвана защитить население от нелегальных лекарственных средств, предоставить гражданам и организациям возможность оперативной проверки их легальности, противодействие незаконному производству, ввозу, обороту лекарственных препаратов на территории Российской Федерации, противодействие недобросовестной конкуренции в сфере оборота лекарственных препаратов, стандартизация и унификация процедур учета поставок и распределения лекарственных препаратов, в том числе закупаемых для государственных нужд.
Общая функциональная схема системы приведена на рисунке ниже.
Постановлением Правительства РФ от 24.01.2017 г. № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» разработчиком и оператором системы МДЛП была определена Федеральная налоговая служба (ФНС). При этом сроком окончания эксперимента по маркировке и мониторингу за оборотом отдельных видов лекарственных препаратов было установлено 31.12.2017 г. Последующими редакциями указанного выше постановления срок окончания эксперимента был перенесен на 31.12.2018 г. Постановлением Правительства РФ от 28.08.2018 № 1018 с 01.11.2018 г. срок окончания эксперимента перенесен на 31.12.2019 г. Этим же постановлением ФНС прекратила информационное сопровождение системы МДЛП С 01.11.2018 г. Информационное сопровождение системы МДЛП (в добровольном порядке) передано обществу с ограниченной ответственностью «Оператор-ЦРПТ»,
Полномочия ООО «Оператор-ЦРПТ» как оператора информационной системы мониторинга движения лекарственных средств подтверждены также распоряжением Правительства РФ от 18.12.2018 г. № 2828-Р (https://medvestnik.ru/content/documents/2828-r-ot-18-12-2018-g.html).
Подробная информация о ходе реализации проекта публикуется на сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзора) http://roszdravnadzor.ru/marking.
Федеральными органами исполнительной власти, уполномоченными на обеспечение проведения эксперимента, являются Министерство здравоохранения Российской Федерации, Министерство промышленности и торговли Российской Федерации, Федеральная служба по надзору в сфере здравоохранения и Федеральная налоговая служба.
Уже сейчас для свободного скачивания доступно разработанное ФМС приложение для смартфонов «Проверка маркировки товаров» (https://play.google.com/store/apps/details?id=ru.fns.markirovka), позволяющее путем сканирования штрих-кода получить информацию о происхождении упаковки лекарства и убедиться, что препарат легален (правда испытать приложение пока проблематично – еще не завершен тестовый эксперимент по нанесению штрих-кодов на упаковки отдельных групп лекарств). Аналогичное приложение разрабатывается и новым оператором системы МДЛП ООО «Оператор-ЦРПТ»: https://честныйзнак.рф/potrebitelyam/.
По такому же принципу, только с использованием специализированных приборов, сканеров, предполагается проводить проверку подлинности лекарственных средств в аптеках и медицинских учреждениях при получении их от поставщика. Помимо этого внедрение системы позволит получать детальные сведения о перемещении упаковки, а также информацию, которая делает невозможным дальнейшее ее обращение (например, наличие данных о том, что упаковка была ранее продана или выведена из обращения по какой-либо другой причин).
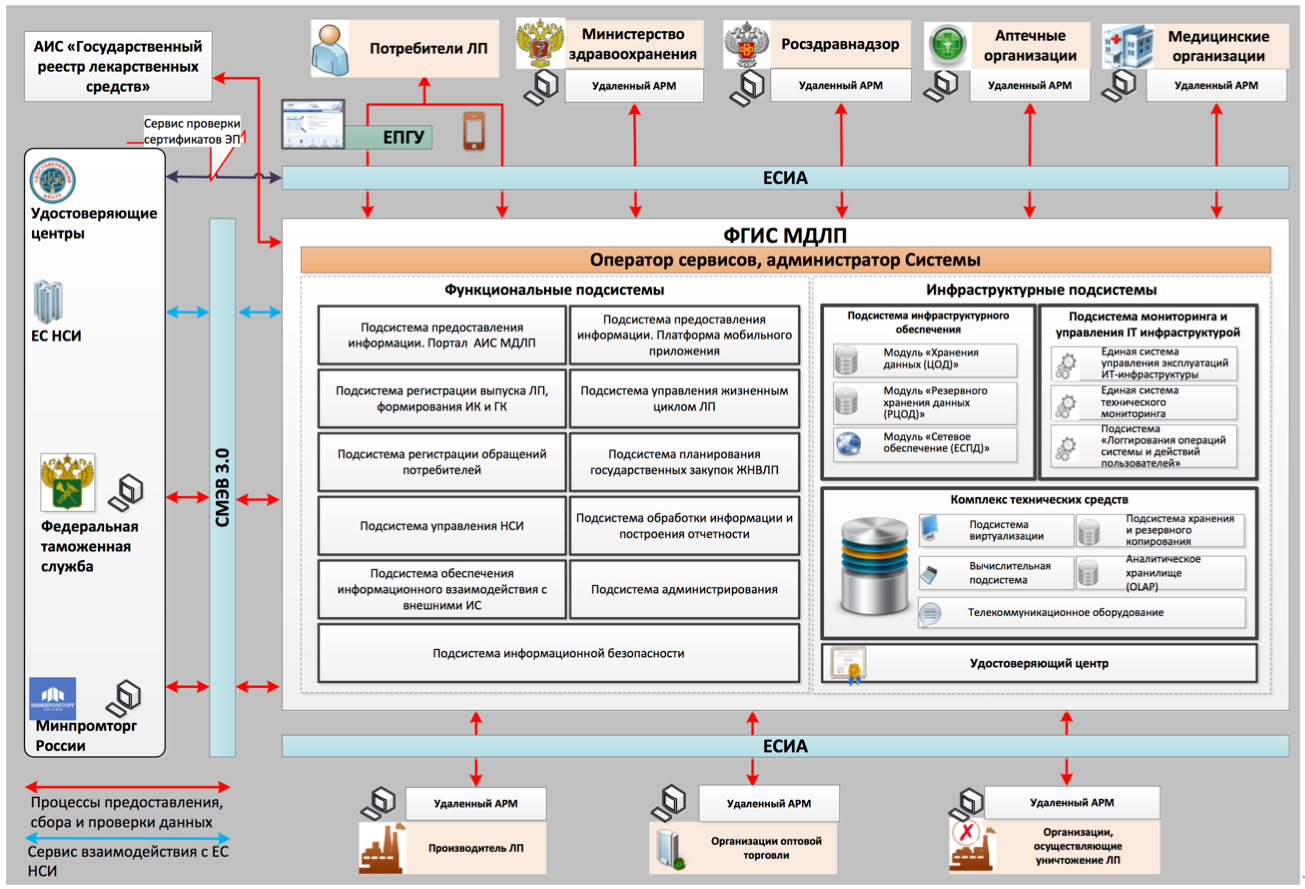
Непосредственными пользователями системы станут все субъекты обращения лекарственных препаратов (ЛП), а именно:
- российские производители ЛП,
- иностранные держатели регистрационных удостоверений ЛП и их представительства,
- организации оптовой и розничной торговли ЛП (аптеки),
- медицинские организации (МО).
Планируется, что по результатам реализации проекта будут задействованы более 350 тысяч субъектов.
Изучение блок-схемы организационного взаимодействия участников (рис. ниже), показывает, что ФГИС МДЛП позволит отслеживать каждое движение лекарственного препарата, начиная с момента его выпуска из производства и заканчивая реализацией конечному потребителю (передачей в медицинские организации для оказания медпомощи, выводом из оборота, списанием или уничтожением).
Перемещение препаратов внутри клиники
Процесс перемещения ЛП между складами или отделениями наиболее прост, так как информация уже загружена во время получения препаратов. Регистратор выбытия при этой процедуре тоже не используется. Достаточно подготовить документ-основание перемещения. Ошибки при выгрузке данных могут возникнуть, если информация о месте перемещения не указана в системе. При этом регистрировать можно только места, указанные в лицензии на медицинскую или фармацевтическую деятельность.
Для справкиОсновная информация об обязательной маркировке ЛП располагается на и официальном сайте Росздравнадзора. Там же можно найти ссылки на законодательные акты и постановления правительства. Для тестирования механизмов взаимодействия медучреждений с ИС «Маркировка» созданы региональные Центры компетенций. Их список есть на сайте оператора системы. Московская ГКБ им. М.П. Кончаловского стала всероссийским Центром компетенции. На ее базе проводится обучение специалистов других медорганизаций. В специальном разделе на сайте больницы выложены материалы с описанием опыта взаимодействия с системой. Во многих материалах указано, что по различным вопросам можно обращаться на электронную почту начальника ИТ-отдела. Однако ответ можно получить только если клиника расположена в Москве и Московской области. Остальным придется обращаться в региональные Центры компетенции. При этом можно столкнуться с тем, что приказ о назначении такого центра не принят. Но в любом случае клиники из списка настраивали обмен с системой и скорее всего поделятся опытом. Полезные документы
|
Немного истории
Внедрение системы мониторинга движения лекарственных препаратов направлено, как правило, на решение следующих задач:
- проверка аутентичности упаковки, т.е. получение информации о том, является ли данная упаковка действительно произведенной конкретным производителем,
- получение сведений о зарегистрированных событиях в прошлом, существование которых делает невозможным дальнейшее обращение данной упаковки. Например, наличие данных о том, что упаковка была ранее продана или выведена из обращения по какой-либо другой причине,
- получение информации об истории перемещения упаковки с момента производства.
В зависимости от дизайна внедряемой системы, решаются все задачи, указанные выше, и тогда говорят о полноценном мониторинге движения лекарственных препаратов или по-английски track & trace, или реализуют только две первые задачи, что называется сериализацией.
Для того, чтобы иметь возможность следить за судьбой упаковок лекарственного препарата, необходимо сделать каждую упаковку уникальной. Для этого на упаковку наносят дополнительные идентификаторы, обозначающие артикул лекарственного препарата и серийный номер упаковки, которые в сочетании с номером производственной серии, делают упаковку лекарственного препарата действительно уникальной.
При этом должна быть обеспечена универсальность кодировки, чтобы все участники рынка могли легко ее считать, оцифровать и в оцифрованном виде обработать (занести в какие-либо базы данных, передать другим участникам рынка и т.д.).
Универсальность кодировки продукции достигается за счет использования штрих-кодов, созданных по общепризнанному стандарту. Наиболее распространены штрих-коды, регламентированные стандартами ИСО, структура (информационное наполнение) которых, разработана Международной Ассоциацией GS1. GS1 является держателем базы данных идентификаторов продукции GTIN, без которых невозможно представить современный товарооборот.
Информационные технологии
Информационные технологии являются ключевым элементом любой системы контроля за перемещением и проверки аутентичности лекарственных препаратов. Они обеспечивают связь между участниками рынка и государственной базой данной, содержащей данные о происхождении и перемещении лекарственных препаратов. На рисунке 3 представлен пример организации системы мониторинга за перемещением лекарственных препаратов.
 Рис. 3. Организация системы мониторинга за перемещением лекарственных препаратов
Рис. 3. Организация системы мониторинга за перемещением лекарственных препаратов
В зависимости от того осуществляется ли только контроль аутентичности упаковки перед передачей лекарственного препарата пациенту, как в европейской модели, или полностью отслеживается перемещение упаковки, начиная от производителя и заканчивая аптекой, как в американской, количество информационных связей между участниками рынка и национальной базой данной, в которой аккумулируется вся информация о ввезенной и обращаемой на рынке продукции, может существенно варьировать. Количество таких связей определяет стоимость эксплуатации национальной системы мониторинга и требования к ее надежности. Для примера, согласно подсчетам уже упоминавшейся EFPIA, ежегодное содержание европейской наднациональной системы, к которой планируется подключение национальных систем, может обойтись до 200 млн евро. Очевидно, что содержание системы, отслеживающей перемещение упаковок лекарственных препаратов от производителя до конечного потребителя будет стоить дороже за счет большего объема обрабатываемой и хранимой информации, а также из-за неизбежного усложнения программных решений. Дополнительным фактором стоимости системы будет обеспечение высокого уровня ее надежности и непрерывности работы. Если по каким-то причинам система перестанет отвечать на запросы субъектов обращения лекарственных препаратов или загрузка производственных данных на серию с учетом сериализации и агрегации до уровня паллеты займет слишком долго времени, то может произойти коллапс. Поэтому так называемые нефункциональные характеристики информационной системы (максимальное время недоступности, скорость обработки запросов и т.д.) должны быть тщательно продуманы и заранее доведены до сведения участников рынка, т.к. при неблагоприятном сценарии они могут повлиять на производительность производственных и логистических операций.
Нанесение необходимой информации на упаковку в виде баркодов или дата матрикс кодов и передача ее в национальную систему не является бесплатной и для производителей лекарственных препаратов. Из того же отчета EFPIA следует, что затраты европейского производителя с годовым объемом продаж 5 млрд евро и 500 млн упаковок в натуральном исчислении составят около 8 млн евро ежегодно. Это не считая затрат на доработку производственных линий для нанесения маркировки и внедрение необходимых интеграционных ИТ-решений, связывающих различные базы данных внутри производственной компании (учет и управление серийными номерами, управление данными на уровне производственной линии, ERP-системы) с внешними партнерами (например, контрактными площадками) и логистическими провайдерами. Единовременные затраты зависят от количества производственных линий, которые необходимо укомплектовать, количества производственных площадок, разнообразия ассортимента продукции и могут составлять от нескольких сотен тысяч до нескольких миллионов евро. Понятно, что при таких затратах на внедрение, любые доработки в будущем также обходятся недешево.
Подключение с внешними организациями чаще всего устанавливают посредством облачных технологий, предоставляемых, например, SAP и TraceLink, что позволяет существенно снизить общие затраты, т.к. нет необходимости разрабатывать и тестировать отдельные интерфейсы с каждым партнером. Возможность функционирования подобных ИТ-решений на территории той или иной страны зависит от наличия в них определенных алгоритмов работы, которые программируются под регуляторные требования конкретных рынков. Ввиду того, что окончательный вариант требований к работе с ИС Маркировка, куда в конечном счете должны будут попадать все информационные потоки, еще не определен, ведущие разработчики программного обеспечения для облачного подключения не спешат дорабатывать свои программные продукты. По предварительным оценкам такие доработки могут занять до полугода, после чего потребуется еще 3 – 4 месяца для установки подключения между производственной компанией или ее представителем на территории РФ и логистическим провайдером, например.
О перспективах развития системы
В планах развития системы, как отмечает министр здравоохранения России Вероника Скворцова, также стоит интеграция ФГИС МДЛП с информационно-аналитической системой (ИАС) мониторинга и контроля в сфере государственных и муниципальных закупок лекарственных препаратов, которая введена в промышленную эксплуатацию с 1 января 2018 г. Внедрение связки данных систем, совместно с использованием персонифицированного учета лекарственных средств, позволит взять под контроль весь процесс лекарственного обеспечения в рамках всей страны. При этом для работы этой системы Минздравом на основании Государственного реестра лекарственных средств (ГРСЛ) разработан единый справочник классификатор лекарственных препаратов (ЕСКЛП), а также выработаны единые принципы ведения и передачи соответствующих структурированных сведений, более подробный комментарий опубликован тут https://www.rosminzdrav.ru/news/2017/12/25/6694-soobschenie-press-sluzhby-minzdrava-rossii. Паспорт справочника ЕСКЛП доступен тут http://portal.egisz.rosminzdrav.ru/materials/607
Общая характеристика системы МДЛП
Медучреждениям придется передавать информацию о получении ЛП от поставщика, их перемещении между отделениями, отпуске препаратов для медицинского применения, уничтожении и временном выводе из оборота. И если во время приемки препаратов информация о маркировке на упаковке и в системе мониторинга не совпадет, лекарства нужно будет возвращать поставщику. Закупать и применять ЛП, данные о которых не внесены в систему, запретят.
Перемещение препаратов должно отражаться в системе в течение 5 рабочих дней. Вероятно, после запуска системы в промышленную эксплуатацию срок будет сокращен до 1 рабочего дня.
ИС «Маркировка» – это электронный документооборот: принимаются только готовые документы, заверенные усиленной цифровой подписью. В ответ на загруженные данные приходит квитанция с положительным или отрицательным результатом. Поэтому к системе нельзя подключить сканнер штрих-кодов или формировать в ней документы о поступлении лекарств (они должны быть подготовлены во внешней системе). Требования к форме и содержанию описаны на официальном сайте оператора МДЛП в разделе Маркировка лекарств» – «Документы» – «Разработчикам».
Способы организации обмена данными:
1) вручную – через ;
2) автоматически – по API.
Ручной вариант предполагает выгрузку документов с помощью личного кабинета на сайте и получение квитанций с результатом в ответ. При этом сами документы нужно готовить вне системы мониторинга. Интеграция по API позволяет организовать автоматический обмен.
Для регистрации на сайте потребуется усиленная цифровая подпись и данные из лицензии на медицинскую или фармацевтическую деятельность. Регистрация двухэтапная. Вначале нужно подтвердить, что организация – резидент РФ и авторизоваться с помощью электронной подписи. Затем откроется окно с заявлением.
ФИО руководителя и ИНН организации в цифровой подписи и в ЕГРЮЛ должны быть одинаковыми. Иначе для регистрации придется перевыпускать электронную подпись или вносить изменения в ЕГРЮЛ.
Срок рассмотрения заявления – 10 рабочих дней. Ответ придет на электронную почту. Статус заявления можно самостоятельно проверить на сайте системы. После подтверждения регистрации необходимо добавить пользователей и места оказания деятельности. Подробно процесс регистрации описан в Руководстве пользователя Личного кабинета.
Процесс выгрузки данных при получении лекарств от поставщика
Первая выгрузка данных в систему мониторинга должна произойти при получении лекарств от поставщика. Работа с ИС «Маркировка» предполагает заключение соглашения в свободной форме между поставщиком и клиникой об информационном обмене через систему. После заключения соглашения стороны добавляют друг друга в список доверенных контрагентов в личном кабинете системы. Заводить данные поставщика не нужно, он выбирается из готового реестра и появится в списке доверенных контрагентов после того, как подтвердит готовность к взаимодействию. Клиника может получить запрос на добавление и от поставщика.
Прямое и обратное акцептирование при приемке лекарств от поставщика
В информационном соглашении обязательно отражается, каким будет акцептирование: прямым или обратным. Загрузка документов с информацией о лекарствах и их передаче силами поставщика является прямым акцептированием. В этом случае клинике остается только подтвердить получение и согласиться с данными поставщика, либо инициировать процедуру возврата. Отсутствие входящего документа является обратным акцептированием. Это означает, что необходимо вносить информацию самостоятельно:
- заполнить реквизиты документа, включая данные о сроках годности, серии, контрольных идентификационных знаках и т.п.;
- отсканировать вторичную и транспортную упаковки.
После отправки документа, подготовленного самостоятельно, нужно получить подтверждение отгрузки от поставщика.
Согласно закону оба варианта равноправны. С точки зрения организации бизнес-процессов разработчики системы предпочтительным считают вариант прямого акцептирования. Скорее всего, именно он получит распространение.
При выгрузке данных в систему важно отслеживать результат регистрации документа в получаемой квитанции. Если он положительный, лекарства можно использовать
В противном случае нужно будет инициировать процесс возврата. Принять от поставщика можно и часть предложенной партии ЛП. Для этого нужно будет самостоятельно создать документ и получить подтверждение от контрагента.
Заключение
По различным экспертным оценкам мировой рынок нелегальной фармацевтической продукции может составлять до 75 млрд долларов с ежегодным приростом в 20% . Ежегодно сотни тысяч людей погибают из-за употребления недоброкачественной лекарственной продукции. Поэтому неудивительно, что регуляторные органы и производители задумываются о дополнительных инструментах контроля рынка для защиты пациентов от контрафакта и фальсификата.
В этом отношении внедрение систем мониторинга за перемещением лекарственной продукции является серьезном барьером на пути некачественных лекарств. Вместе с тем не стоит недооценивать негативные последствия, к которым могут привести ошибки при внедрении такого рода систем. Не случайно сроки внедрения сериализации в ряде стран часто переносились.
Дождемся окончания эксперимента по маркировке лекарственных препаратов контрольно-идентификационными знаками. Посмотрим на результаты. И будем надеяться, что у нас будет время дать необходимую оценку тому, что удалось, а что нет, извлечь уроки и проделать необходимую работу над ошибками перед стартом.
Источники информации:
- по итогам совещания с членами Правительства.
- по маркировке контрольными (идентификационными) знаками лекарственных препаратов.
- ; Prescription Drug Amendments of 1992; Policies, Requirements, and Administrative Procedures; Delay of Effective Date — A Rule by the Food and Drug Administration on 03/01/2001.
- — Pedigree Requirements under 21 CFR Part 203.
- Application of Track & Trace Technologies to Containers. New England PDA (NEPDA) September 17, 2008 Burlington, MA.
- — Standardized Numerical Identifcation for Prescription Drug Packages.
- . Phil Taylor 23-Oct-2009.
- По материалам www.infosys.com
- Delegated Act on the Detailed Rules for a Unique Identifer for Medicinal products for Human use, and its Verifcation Concept Paper submitted for Public Consultation, EFPIA Individual Response, 26 April 2012
- : The promise of global standards in healthcare, October 2012.
Автор материала: Михаил Хазанчук, эксперт по вопросам GMP/GDP
Материал опубликован в журнале «Новости GMP» №2 (13) лето 2017