Гост 6055-86 вода. единица жесткости
Содержание:
- Влияние жесткой воды на здоровье человека и коммуникации
- Что такое жёсткость воды и почему её нужно определять
- Источники жесткости в воде
- Принятые нормативы жесткости
- Библиография
- 3.4 Состав стандартной жесткой воды
- 4 Приготовление стандартной искусственной жесткой воды
- 4.2 Повышение жесткости воды. Метод А
- Как определить жесткость воды в лаборатории
- 2 Нормативные ссылки
- ,, 1
- Удаление минеральных солей
- ПОДГОТОВКА К АНАЛИЗУ
- Очистка жесткой воды
- Как измерить жёсткость
Влияние жесткой воды на здоровье человека и коммуникации
Проблемы жесткости воды присуща почти всем крупным городам, так как водопровод берет воду из скважин.
Негативное влияние жесткости водопроводной воды на здоровье человека выражается в следующем:
- Реакция кожи – сухость, зуд, шелушение, аллергии, перхоть;
- Уничтожение сальной пленки – голова быстрее грязнится, а тело быстро теряет свежесть, удаляется защитный слой кожи (главное препятствие микробам и вирусам);
- Проблемы с ЖКТ;
- Накопление токсинов в организме ;
- Заболевания сердечно-сосудистой системы в результате избытка кальция и магния;
- Влияние на опорно-двигательную систему – жесткая вода приводит к уменьшению суставной жидкости и снижает подвижность тела;
- Появление камней в почках.
Если вода обладает повышенной жесткость, то стенки водопроводных труб и отопительной системы покрываются налетом, который препятствует нормальной проходимости и нагреву.
Что такое жёсткость воды и почему её нужно определять
На жёсткость воды влияет содержание в ней солей щёлочноземельных металлов, в частности кальция и магния. Положительно заряженные ионы этих минералов растворены в воде и влияют на её характеристики. Чем меньше солей содержится в воде, тем она мягче.
Различается два вида жёсткости: временная и постоянная. В первом случае проблема легко решается кипячением. Во втором придётся прибегать к очистным фильтрам.

Жёсткость воды обозначается градусами и мг-эквивалентами на 1 л.
1 мг-экв./л равен 20,04 мг кальция и 12,6 мг магния.
Допустимый предел жёсткости:
- в странах бывшего СССР — 7 мг-экв./л;
- В Европе — до 1,2 мг-экв./л.
По градусам жёсткости выделяется три категории воды:
Жёсткая — более 10°Ж.
- Средней жёсткости — от 2 до 10 °Ж.
- Мягкая — до 2 °Ж.
Интересно, что даже средняя жёсткость воды вызывает дискомфорт.
Почему нужно проверять жёсткость водопроводной воды? При регулярном употреблении человеком некачественного питья возникают такие проблемы, как камни в почках, печени и желчном пузыре. Определение жёсткости позволит скорректировать показатель до нормы и использовать ресурс без опасений.

Косвенным признаком жёсткости воды является не только известковый налёт на чайнике и посуде, но и некорректная работа приборов — посудомоечной, стиральной машины, кофемашины. При протечке крана появляются следы водного камня на сантехнике. Очищенная вода продлит срок службы бытовых приборов. Проверить жёсткость воды можно в лаборатории, а также домашними приёмами.
Источники жесткости в воде
Источники жесткости в воде имеют исключительно природный характер, это единственная экологическая проблема, которой не присущ антропогенный фактор. Основная причина – поступление солей из подземных источников, расположенных в известняковых пластах. Именно поэтому показатель жесткости поверхностных вод ниже, чем у подземных.
Кроме того, жесткость может зависеть от сезонности. Минимальное значение она достигает весной, когда тает снег и наступает половодье.
Жесткая вода в квартире имеет те же причины, что и водоемная. Она поступает из скважин, в которых растворяются залежи пород гипса, известняка и доломитов.
Принятые нормативы жесткости
В Российской Федерации есть некоторые расхождения норм с международными стандартами. Разнообразие природных и климатических условий, вариативность используемых для добычи питьевой воды и жидкости для бытового использования не позволяет установить безоговорочно единые нормативы, обязательные для любого региона.

Пояснение нормативов
Однако нормы жесткости воды питьевой в целом соответствуют рекомендациям ВОЗ. В неблагополучной экологической обстановке они приводятся в соответствие с санитарно-гигиеническими нормами страны различными способами. Вариантов для этого достаточно много.
На сегодняшний день потребитель может сам контролировать наличие в воде, подаваемой из крана, нормы показателя жесткости и устанавливать различные приспособления для приведения ее в соответствие нормам санитарии и гигиены.
Приведенные ниже нормы касаются временной жесткости, устранение которой возможно и самыми простыми способами. В домашних условиях самый известный – паровой – проводится кипячением воды в чайнике.
Таблица показателей норм кальция и магния по требованиям СанПиН РФ и нормативам ВОЗ.
| Нормативный документ | Продукт | Магний | Кальций | °Ж |
| СанПиН 2.1.4.1074-01; ГН 2.1.5.1315-03 | Питьевая вода | до 50 мг/л | не регламентируется | 7 |
| СанПиН 2.1.4.1116-02 | Бутилированная вода | 5–65 мг/л | 25–130 мг/л | 1,5–7 |
| Рекомендации ВОЗ | Питьевая вода | 10–30 мг/л | 20–80 мг/л | не обозначается |
Измерение в градусах жесткости выглядит следующим образом: менее двух °Ж – это мягкая вода, начиная с двух и до десяти °Ж средней жесткости – нормальный уровень, более 10 – жесткая. Однако в аквариуме нормальным может считаться и показатель в 15 градусов жесткости. Все зависит от того, какие в нем живут обитатели.
Библиография
|
Международный стандартISO 5725-6:1994* |
Accuracy (trueness and precision) of measurement methods and results. Part 6. Use in practice of accuracy values (Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике) |
|
|
_______________* В Российской Федерации действует ГОСТ Р ИСО 5725-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике». До принятия межгосударственного стандарта используют аналогичные национальные стандарты, если они идентичны международному стандарту ISO 5725-6:1994. |
||
|
Руководство ЕВРОХИМ/СИТАК «Количественное описание неопределенности в аналитических измерениях»*. 2-е издание, 2000, пер. с англ. — СПб, ВНИИМ им.Д.И.Менделеева, 2002 г. |
||
|
________________* Документ в информационных продуктах не содержится. За информацией о документе Вы можете обратиться в Службу поддержки пользователей. — . |
||
|
РекомендацияМИ 2881-2004 |
Государственная система обеспечения единства измерений. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа |
|
УДК 663.6:006.354 |
МКС 13.060.50 |
Н09 |
ТН ВЭД 220100000 |
NEQ |
|
220100000 |
||||
|
Ключевые слова: питьевая вода, природная вода, жесткость, методы определения, комплексонометрия, атомная спектрометрия |
Электронный текст документа и сверен по:официальное изданиеМ.: Стандартинформ, 2018
3.4 Состав стандартной жесткой воды
3.4.1 Состав воды, приготовленной по методу А
Компонент временной жесткости стандартной воды образован
бикарбонатом кальция (Са(НСО3)2), а компонент постоянной
жесткости — равными частями хлорида кальция (СаСl2) и сульфата магния (MgSO4).
Концентрация ионов в жесткой воде, обеспечиваемая при
приготовлении ее методом А, приведена в таблице .
Таблица 1
Концентрация ионов стандартной жесткой воды
Молярная масса
Общая жесткость
3,00 ммоль/л
1,50 ммоль/л
0,50 ммоль/л
мг/л
ммоль/л
мг/л
ммоль/л
мг/л
ммоль/л
Са
40,0
100
2,50
50
1,25
17
0,42
Mg
24,3
12
0,50
6
0,25
2
0,08
НСО3
61,0
244
4,00
122
2,00
41
0,67
Сl
35,5
35
1,00
18
0,50
6
0,17
SO4
96,0
48
0,50
24
0,25
8
0,08
Временная жесткость, ммоль/л
2,00
1,00
0,33
Общее количество растворенных твердых частиц, мг/л
439,70
220,90
73,60
3.4.2 Состав
воды, приготовленной по методу Б
Компонент временной жесткости стандартной жесткой воды
образован бикарбонатами кальция и магния (Са(НСО3)2) и
(Mg(HCO3)2).
Компонент постоянной жесткости образован хлоридами и сульфатами
кальция и магния (СаСl2,
CaSO4, MgCl2,
MgSO4). Концентрация ионов в жесткой воде, обеспечиваемая при
приготовлении ее по методу Б, приведена в таблице .
Таблица 2
Концентрация ионов стандартной жесткой воды
Молярная масса
Общая жесткость
3,00 ммоль/л
1,50 ммоль/л
0,50 ммоль/л
мг/л
ммоль/л
мг/л
ммоль/л
мг/л
ммоль/л
Са
40,0
89
2,23
45
1,11
15
0,37
Mg
24,3
19
0,77
9
0,39
3
0,13
НСО3
61,0
244
4,00
122
2,00
41
0,67
Сl
35,5
158
4,46
79
2,23
26
0,75
SO4
96,0
74
0,77
37
0,39
12
0,13
Na
23,0
92
4,00
46
2,00
15
0,67
Временная жесткость, ммоль/л
2,00
1,00
0,33
Общее количество растворенных твердых частиц, мг/л
676,00
338,00
112,00
Избыток ионов
натрия, хлора м сульфата в жесткой воде, приготовленной по методу Б, по
сравнению с количеством ионов в жесткой воде, приготовленной по методу А,
указан в таблице .
Таблица 3
Молярная масса
Общая жесткость
3,00 ммоль/л
1,50 ммоль/л
0,50 ммоль/л
мг/л
ммоль/л
мг/л
ммоль/л
мг/л
ммоль/л
Na
23,0
92
4,00
46
2,00
15
0,67
Сl
35,5
123
3,46
61
1,73
20
0,58
SO4
96,0
26
0,27
13
0,14
4
0,05
4 Приготовление
стандартной искусственной жесткой воды
4.2 Повышение жесткости воды. Метод А
Осушенный карбонат кальция (СаСО3) взвешивают в
количестве, зависящем от количества и желаемой степени жесткости приготовляемой
жесткой воды из расчета: 0,033; 0,100 или 0,200 г на каждый литр приготовляемой
жесткой воды со степенями жесткости 0,50; 1,50 и 3,00 ммоль/л соответственно.
Указанное количество бикарбоната кальция смешивают с
небольшим количеством деминерализованной воды до образования шлама, а затем
добавляют последний в оставшееся количество деминерализованной воды.
При помощи стержневых или кольцевых распылителей с
небольшими отверстиями, смонтированных на дне резервуара, медленно вдувают
углекислый газ. Давление углекислого газа перед введением в резервуар снижают
примерно до 35 кПа при помощи клапана сброса. При необходимости клапан нагревают
во избежание его замораживания.
Эту операцию, которая снижает показатель концентрации
водородных ионов рН и превращает нерастворимый карбонат кальция в растворимый
бикарбонат кальция, продолжают до тех пор, пока вода станет прозрачной.
Операция может длиться в течение 1 — 3 ч в зависимости от количества
приготовляемой жесткой воды и степени жесткости.
Для жесткости 3,00 ммоль/л устойчивый раствор получается при
значении рН, равном 7,5. Для более мягкой воды (с меньшей жесткостью)
допускаются более высокие значения рН, например:
для 1,50 ммоль/л — от 7,5 до 8,0 рН;
для 0,50 ммоль/л — от 8,0 до 8,3 рН.
Затем добавляют твердый хлористый кальций в соответствии с
половиной значения требуемой постоянной жесткости и требуемого количества
приготовляемой воды (1,47 мг CaСl2·2 Н2O на один литр обеспечивают
жесткость 0,01 ммоль/л).
После этого добавляют твердый сернокислый магний (сульфат
магния) в количестве, равном другой половине значения требуемой постоянной
жесткости (2,46 мг MgSO4·7 Н2О на один литр обеспечивает
жесткость 0,01 ммоль/л).
Если конечное значение рН находится ниже диапазона,
соответствующего требуемой степени жесткости, то в воду следует вводить воздух,
чтобы фактическое значение рН поднять до уровня, находящегося в пределах
значений диапазона. При нормальной рабочей температуре такая вода является
устойчивой.
Перед использованием воды необходимо повторно отрегулировать
рН с помощью HCl или
NaOH.
Примечание — Вода
может стать неустойчивой при поступлении в нее воздуха при ее взбалтывании или,
если она хранится на открытом воздухе.
Как определить жесткость воды в лаборатории
Бывают случаи, когда нужно как можно точнее определить жесткость воды.
Как уже говорилось выше, самый доступный, используемый повсеместно метод определения количества солей в воде, – титрование. Однако точность этого метода относительно невысока.
Один из самых точных приборов, помогающих определить концентрацию солей, по мнению сотрудников лабораторий, – АКМС-1. На экран прибора автоматически выводятся результаты сравнения разности электродных потенциалов и эталонных значений.

Резонансное поглощение фотонов атомами анализируемых элементов является основой метода атомной спектрометрии. Данный метод отличается высокой точностью, однако стоимость приборов, применяемых в нем, довольно высока.
Статьи, рекомендуемые к прочтению:
- Как удалить накипь в чайнике: методы и рекомендации
- Комплект очистки воды: для чего он необходим
- Очистка воды от запаха: устраняем не только запах, но и его причину
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования котбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 1770-74 (ISO 1042-83, ISO 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2053-77 Реактивы. Натрий сернистый 9-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3760-79 Реактивы. Аммиак водный. Технические условия
ГОСТ 3773-72 Реактивы. Аммоний хлористый. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 5456-79 Реактивы. Гидроксиламина гидрохлорид. Технические условия
ГОСТ 5457-75 Ацетилен растворенный и газообразный технический. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 10652-73 Реактивы. Соль динатриевая этилендиамин-N,N,N’,N’-тетрауксусной кислоты 2-водная (трилон Б). Технические условия
ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 23950-88 Вода питьевая. Метод определения массовой концентрации стронция
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251-91 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 31861-2012 Вода. Общие требования к отбору проб
ГОСТ 31862-2012 Вода питьевая. Отбор проб
ГОСТ 31865-2012 Вода. Единица жесткости
ГОСТ 31870-2012 Вода питьевая. Определение содержания элементов методами атомной спектрометрии
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
,, 1
где , фактор
эквивалентности.
Примечание Фактор эквивалентности — число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительновосстановительной реакции
Отношение количества вещества эквивалента в системе (например, в растворе) к объему этой системы
Примечание Количество вещества экви* валента —- количество вещества (в молях), в котором частицами являются эквиваленты.
ПРИЛОЖЕНИЕ 3 Справочное
СООТНОШЕНИЕ ЕДИНИЦ ЖЕСТКОСТИ ВОДЫ, ПРИНЯТЫХ В ДРУГИХ СТРАНАХ С ЕДИНИЦЕЙ МОЛЬ НА КУБИЧЕСКИЙ МЕТР (моль/м3]
Единицы жесткости воды
|
моль/м3 |
Немецкий |
Французский |
Американский |
|
градус |
градус |
градус |
|
|
1,000 |
2,804 |
5,005 |
50,050 |
Примечания*
1. Один немецкий градус соответствует 10 мг/л СаО в воде.
2. Один французский градус соответствует 10 мг/л СаСОэ в воде.
3. Один американский градус соответствует 1 мг/л СаСОз в воде.
Сдано в наб Тир 20 000
Ордена «Знак
Редактор Т. И. Василенко Технический редактор Н. В. Белякова Корректор Е. И. Морозова
09 04 86 Подп в печ 20 06 86 0,5 уел п л 0,5 уел кр отт 0,22 уч изд л.
Цена 3 коп.
Почета» Издательство стандартов, 123840, Москва, ГСП, Новопресненскнй лер,, 3 Тип. «Московский печатник», Москва, Лялин пер., 6. За к. 2063
Цена 3 коп.
|
Велн ^ина |
Едн» то |
||
|
Наименование |
Обозначение |
||
|
междунае сдное |
русское |
||
|
0 С Н 0 В н ы |
Е ЕД И НИ L |
1 Ы СИ |
|
|
метр |
ш |
м |
|
|
Масса |
килограмм |
кг |
|
|
Время |
секунда |
S |
с |
|
Сила электрического тока |
ампер |
А |
А |
|
Термодинамическая температура |
кельвин |
К |
К |
|
Количество вещества |
моль |
то] |
моль |
|
С *ла света |
кандела |
cd |
кд |
|
ДОПОЛНИТЕЛЬНЫЕ ЕД |
, И Н И ЦЫ СИ |
||
|
ТПлоский угол |
радиан |
rad |
рад |
|
клееный угол |
стерадиан |
sr |
СР |
ПРОИЗВОДНЫЕ ЕДИНИЦЫ СИ, ИМЕЮЩИЕ СПЕЦИАЛЬНЫЕ НАИМЕНОВАНИЯ
|
Единица |
Выражение через основные и до- |
|||
|
Величина |
Обозначение |
|||
|
Наименова ние |
междунэ родное |
русское |
полннтельные единицы СИ |
|
|
Частота |
герц |
Н 7 |
Гц |
с-‘ |
|
Сила |
ньютон |
N |
Н |
м кг с~г |
|
некие |
паскаль |
Pi |
Па |
М“1 • кг с-2 |
|
О* оргия |
джоуль |
J |
Дж |
М2 КГ С—2 |
|
Мощность |
ватт |
W |
Вт |
м2 кг с-3 |
|
Количество электричества |
кулон |
С |
Кл |
с А |
|
Электрическое напряжение |
вольт |
V |
В |
м2 кг с“э • А~* |
|
Электрическая емкость |
фарад |
F |
Ф |
м~2кг—1 — с 4 А2 |
|
Электрическое сопротивление |
ом |
( у |
Ом |
м2 кг с-‘5 А-2 |
|
-Электрическая проводимость |
сименс |
S |
См |
м 2Ki 1 с3 А2 |
|
Поток тдагнитной индукции |
вебер |
Wh |
Вб |
м2 * кг- с-2 А’1 |
|
Магнитная индукция |
гесла |
Т |
Тл |
кг с-2 А-1 |
|
Индуктивность |
генри |
Н |
Гн |
м2 кг с-2-А”2 |
|
Световой поток |
люмен |
1т |
лм |
КД * ср |
|
Освещенность |
люкс |
1х |
лк |
м ~2 • кд * ср |
|
Активность радионуклида |
беккерель |
Bq |
Бк |
С-1 |
|
Поглощенная доза ионизирую* |
грэй |
Gy |
Гр |
м2 * с“2 |
|
щего излучения Эквивалентная доза излучения |
зивеот |
Sv |
Зв |
м2 * с”2 |
Удаление минеральных солей
Деминерализация (или процесс удаления минеральных веществ) проводят способами деионизации, дистилляции, электролиза, обратного осмоса, что зачастую требует определённой подготовки ресурса, но позволяет достичь очень высокой (до 99,9%) степени очистки, как это происходит при использовании мембранных систем.
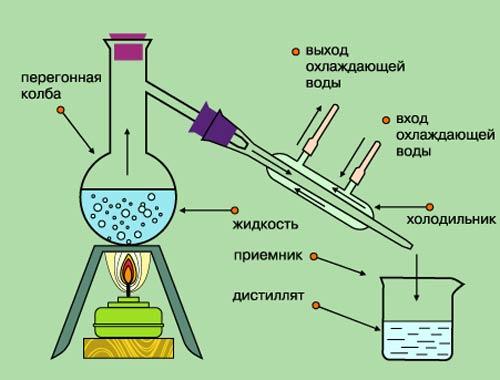
- Дистилляция. В основе принципа – выпаривание и концентрация пара. Технология считается энергоёмкой и проходит с образованием накипи на стенках испарителя.
- Электродиализ. Процесс происходит благодаря перемещению ионов в электрическом поле с установкой ионоселективных мембран, пропускающих только катионы или только анионы, в результате чего в ограниченном мембранами объёме снижается концентрация солей.
- Деионизация. Обессоливание обеспечивает ионный обмен в 2 слоях ионообменного материала. Деионизированная вода используется в фармацевтике, химии, обработке кож и др.
- Обратный осмос. Очистка основана на «продавливании» капель сквозь полупроницаемую мембрану с порами, сопоставимыми по размеру с молекулой Н2О. Под давлением сквозь мембрану проходит только сама молекула, низкомолекулярные газы, а примеси отфильтровываются и сливаются.
Водоресурс для этого процесса требует предварительной очистки от ржавчины, песка и др. взвесей сначала с помощью механических ячеистых (с размером до 5 микрон) картриджей, затем – фильтров с гранулированным углём, сорбирующим металлы, свободный хлор, и затем – фильтров с прессованным кокосовым углём для устранения хлорорганических соединений.
Такие мембраны-фильтры нельзя сравнивать ни по функциям, ни по масштабу с сетками-фильтрами, устанавливаемыми на аэраторах и экономителях воды (например, http://water-save.com/). В экономителях фильтры гораздо крупнее и решают совершенно другие задачи аэрирования воды и создания эффекта «полной» струи при меньшем фактическом водорасходе.
Читайте далее
ПОДГОТОВКА К АНАЛИЗУ
3.1. Дистиллированная вода, перегнанная дважды в стеклянном приборе, используется для разбавления проб воды.
3.2. Приготовление 0,05 н. раствора трилона Б
9,31 г трилона Б растворяют в дистиллированной и доводят до 1 дм3. Если раствор мутный, то его фильтруют. Раствор устойчив в течение нескольких месяцев.
3.3. Приготовление буферного раствора
10 г хлористого аммония (NH4Cl) растворяют в дистиллированной воде, добавляют 50 см3 25 %-ного раствора аммиака и доводят до 500 см3 дистиллированной водой. Во избежание потери аммиака раствор следует хранить в плотно закрытой склянке.
3.4. Приготовление индикаторов
0,5 г индикатора растворяют в 20 см3 буферного раствора и доводят до 100 см3 этиловым спиртом. Раствор индикатора хрома темно-синего может сохраняться длительное время без изменения. Раствор индикатора хромогена черного устойчив в течение 10 сут. Допускается пользоваться сухим индикатором. Для этого 0,25 г индикатора смешивают с 50 г сухого хлористого натрия, предварительно тщательно растертого в ступке.
3.5. Приготовление раствора сернистого натрия
5 г сернистого натрия Na2S×9H2O или 3,7 г Na2S×5H2O растворяют в 100 см3 дистиллированной воды. Раствор хранят в склянке с резиновой пробкой.
3.6. Приготовление раствора солянокислого гидроксиламина
1 г солянокислого гидроксиламина NH2OH×HCl растворяют в дистиллированной воде и доводят до 100 см3.
3.7. Приготовление 0,1 н. раствора хлористого цинка
Точную навеску гранулированного цинка 3,269 г растворяют в 30 см3 соляной кислоты, разбавленной 1:1. Затем доводят объем в мерной колбе дистиллированной водой до 1 дм3. Получают точный 0,1 н. раствор. Разведением этого раствора вдвое получают 0,05 н. раствор. Если навеска неточная (больше или меньше чем 3,269), то рассчитывают количество кубических сантиметров исходного раствора цинка для приготовления точного 0,05 н. раствора, который должен содержать 1,6345 г цинка в 1 дм3.
3.8. Приготовление 0,05 н. раствора сернокислого магния
Раствор готовят из фиксанала, прилагаемого к набору реактивов для определения жесткости воды и рассчитанного на приготовление 1 дм3 0,01 н раствора. Для получения 0,05 н. раствора содержимое ампулы растворяют в дистиллированной воде и доводят объем раствора в мерной колбе до 200 см3.
3.9. Установка поправочного коэффициента к нормальности раствора трилона Б
В коническую колбу вносят 10 см3 0,05 н. раствора хлористого цинка или 10 см3 0,05 н. раствора сернокислого магния и разбавляют дистиллированной водой до 100 см3. Прибавляют 5 см3 буферного раствора, 5 — 7 капель индикатора и титруют при сильном взбалтывании раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с фиолетовым оттенком при прибавлении индикатора хрома темно-синего и синей с зеленоватым оттенком при прибавлении индикатора хромогена черного.
Титрование следует проводить на фоне контрольной пробы, которой может быть слегка перетитрованная проба.
Поправочный коэффициент (К) к нормальности раствора трилона Б вычисляют по формуле
,
где v — количество раствора трилона Б, израсходованное на титрование, см3.
Очистка жесткой воды
Жесткость воды в Московской области часто превышает допустимые пределы, поэтому ее необходимо смягчать перед использованием. Средняя жесткость воды в Москве составляет 5,5 мг-экв/л, что тоже является немалым.
Полностью устранить жесткость воды может только фильтр.
Лучший способ устранения жесткости – это метод ионного обмена. Ионообменные смолы в фильтрах умягчают воду, вступая в реакцию с растворенными солями. Результатом деятельности является отдача ионов. Смолы обладают способностью к регенерации в течении нескольких лет, поэтому такие фильтры очень выгодны в использовании.
Лаборатория «ИОН» проводит анализ воды всех видов. Мы работаем более 20-ти лет и гарантируем качественное выполнение услуг. Проводим отбор проб в Москве и Московской области воды любого назначения. Гарантируем качество и 100% соблюдение сроков.
Все статьи
Как измерить жёсткость
Существуют ситуации, когда необходимо узнать жесткость воды для посудомоечной машины или определить ее пригодность для разведения аквариумных рыбок. Существует несколько способов проверить воду в домашних условиях. Естественно, без лаборатории все тесты весьма условны и не каждый сможет ими воспользоваться, так как не сможет понять разницы.
- Проверить, как пенится мыло. Просто намыльте руки мылом, если оно хорошо пенится и легко смывается, значит, вода не очень жесткая и наоборот. Такой способ поможет определить лишь крайние показатели жесткости.
- Проверьте интенсивность образования накипи на стенках чайника или тэнах нагревательных приборов, чем слой толще, тем выше жесткость. Проблема заключается в том, что невозможно определить непродолжительные изменения состава, процесс образования накипи не быстрый и способен дать лишь общее представление и только о временной жесткости.
- Попробуйте воду на вкус, жесткая вода будет горьковатой. Способ также весьма приблизительный, не каждый человек сможет выступить в роли гурмана и понять разницу.
- Более точную картину дают индикаторы жесткости, продаются чаще в виде бумажек, пропитанных специальным составом, меняющим цвет в зависимости от состава жидкости.
- Есть и технические средства для измерения состава воды. Их называют TDS-метрами, приборы определяют общее количество растворенных в воде веществ. Устройство компактное и подходит к использованию в домашних условиях.
Не стоит забывать, что вода способна навредить бытовой технике или аквариумным рыбкам. Вода участвует во всех обменных процессах нашего организма и способна вызвать неприятные последствия, особенно часто вода из-под крана вызывает раздражение или сухость кожи, но может и стать причиной камней в почках.