Химический анализ сточных вод
Содержание:
- Жесткость
- Минеральные соли в технической воде
- 12 КОНТРОЛЬ ТОЧНОСТИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
- Общая минерализация
- 5.2 Реактивы и материалы
- 6 УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
- 8 УСЛОВИЯ ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
- 9 ОТБОР И ХРАНЕНИЕ ПРОБ
- 8 ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЙ
- Общая минерализация: понятие и категории
- Санитарные нормы
- Хлориды
- 11.2 Вычисление содержания прокаленного остатка
- 12 ПРОВЕРКА ПРИЕМЛЕМОСТИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ, ПОЛУЧЕННЫХ В УСЛОВИЯХ ВОСПРОИЗВОДИМОСТИ
- 13 КОНТРОЛЬ КАЧЕСТВА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ ПРИ РЕАЛИЗАЦИИ МЕТОДИКИ В ЛАБОРАТОРИИ
- Вкусовые признаки и обеспечение минералами организма через воду
Жесткость
Понятие жесткости воды принято связывать с катионами кальция (Са2+), магния (Mg2+) и железа (Fe2+, Fe3+). Они взаимодействуют с анионами, образуя соединения (соли жесткости), способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают. Жесткая вода содержит много минеральных солей, от которых на стенках посуды, котлах и других агрегатах образуется накипь — каменная соль. Жесткая вода губительна и непригодна для систем водоснабжения. В такой воде плохо заваривается чай, плохо растворяется мыло. В таблице 4 приведены основные катионы металлов, вызывающие жесткость, и анионы, с которыми они ассоциируются.
Минеральные соли в технической воде
Для технической жидкости по ряду отраслей промышленности возникает необходимость обеспечить более строгие нормы солесодержания. Так предотвращение отложений солевого осадка в пароводяных трактах ТЭЦ или ТЭС может быть обеспечено присутствием солей в минимальном количестве – меньше 1мг/литр – в обеих средах (менее 1 мг/л).
При движении гидропотока по трубам перенасыщенности минеральными солями с учётом низкой концентрации и относительно низкой температуры, как правило, не наблюдается, однако в пограничных слоях с малой скоростью потока, при наличии шероховатости на стенках труб, дефектах изоляции и т.д. могут быть спровоцированы осаждения.
Тенденции к строгому нормированию качества технического водоресурса имеют два направления:
- создание параметров по каждому показателю, аналогично тому, как это сделано для питьевых ресурсов;
- создание моделей водосостава для технических целей, которые не делили бы норматив по отдельным физико-химические показателям, а включали бы целый комплекс свойств.
12 КОНТРОЛЬ ТОЧНОСТИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
где — результат анализа массовой концентрации сухого остатка в пробе, разбавленной в два раза, — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (3).
где — стандартные отклонения промежуточной прецизионности, соответствующие массовой концентрации сухого остатка в разбавленной пробе и в исходной пробе соответственно.
Процедуру анализа признают удовлетворительной при выполнении условия:
Кк£К (6)
При невыполнении условия (6) контрольную процедуру повторяют. При повторном невыполнении условия (6) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Общая минерализация
Общая минерализация — это показатель содержания растворенных в воде веществ или общее солесодержание, поскольку вещества, растворенные в воде, находятся в виде солей (гидрокарбонаты, хлориды и сульфаты кальция, магния, калия и натрия). Вода поверхностных источников имеет меньший плотный осадок, чем вода подземных источников, т.е. содержит меньше растворенных солей. Предел минерализации питьевой воды (сухого остатка) 1000 мг/л был в свое время установлен по органолептическому признаку. Воды с большим содержанием солей имеют солоноватый или горьковатый привкус. Допускается содержание их в воде на уровне порога ощущения: 350 мг/л для хлоридов и 500 мг/л для сульфатов. Нижним пределом минерализации, при котором гомеостаз организма поддерживается адаптивными реакциями, является сухой остаток в 100 мг/л, оптимальный уровень минерализации 200-400 мг/л. При этом минимальное содержание кальция должно быть не менее 25 мг/л, магния -10 мг/л. По общей минерализации воды делятся на следующие категории (Таблица 5):
Таблица 5. Категории вод по степени общей минерализации
Категория вод
Минерализация, г/дм3
Рассолы
> 35
Воды повышенной солености
10 — 35
Соленые
3 — 10
Солоноватые
1.0 — 3.0
Воды с повышенной минерализацией
0.5 — 1.0
Пресные
0.2 — 0.5
Ультрапресные
< 0.2
5.2 Реактивы и материалы
5.2.1 Вода дистиллированная по ГОСТ 6709
или для лабораторного анализа по ГОСТ
Р 52501 (2-ой степени чистоты), (далее вода дистиллированная).
5.2.2 Кислота соляная по ГОСТ 3118,
х.ч.
5.2.3 Железо (III) хлорид (хлорное железо), 6-водное по ГОСТ
4147, ч., насыщенный раствор (для маркировки бюксов).
5.2.4 Фильтры бумажные «синяя лента» диаметром 15 см, с
массой золы (0,0016 — 0,0020) г по ТУ
6-09-1678 или по ТУ
2642-001-42624157.
5.2.5 Фильтры мембранные с диаметром пор 0,45 мкм.
Допускается использование реактивов более высокой
квалификации, а также материалов с аналогичными или лучшими характеристиками.
6 УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
6.1 При выполнении анализов необходимо соблюдать требования
техники безопасности при работе с химическими реактивами по ГОСТ
12.1.007.
6.2 При работе с оборудованием необходимо соблюдать
требования электробезопасности при работе с электроустановками по ГОСТ
Р 12.1.019 и требования техники безопасности при работе с муфельной печью в
соответствии с инструкцией по эксплуатации.
6.3 Организация обучения работающих безопасности труда
должна проводиться по ГОСТ
12.0.004.
6.4 Помещение лаборатории должно соответствовать требованиям
пожарной безопасности по ГОСТ
12.1.004 и иметь средства пожаротушения по ГОСТ
12.4.009.
8 УСЛОВИЯ ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
При выполнении измерений в лаборатории должны быть соблюдены
следующие условия:
|
температура воздуха |
от 20 °С до 28 °С |
|
относительная влажность воздуха |
не более 80 % при 25 °С |
|
напряжение в сети |
(220 ± 22) В. |
9 ОТБОР И ХРАНЕНИЕ ПРОБ
9.1 Отбор проб производится в соответствии с ГОСТ Р 51592
и ГОСТ Р 51593. Отбор
проб воды осуществляют в стеклянные или пластиковые флаконы. Пробы снега в
соответствии с ГОСТ
17.1.5.05 переводят в талую воду при комнатной температуре.
9.2 Объём отбираемый пробы должен быть (1000 — 2000) см3
для питьевой и природной воды и не менее 250 см3 — для сточной или
загрязненной пробы воды.
9.3 Срок хранения пробы 24 часа при температуре (2 — 10) °С.
9.4 При отборе проб составляют сопроводительный документ по
утвержденной форме, в котором указывают:
— цель анализа;
— место, дату и время отбора;
— шифр пробы;
— должность, фамилию сотрудника, отбирающего пробу.
8 ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЙ
8.1 Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб промывают водопроводной водой, обрабатывают хромовой смесью, тщательно промывают водопроводной, затем 3 — 4 раза дистиллированной водой.
8.2 Отбор и хранение проб
Отбор проб питьевых вод производится в соответствии с требованиями ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб».
Отбор проб поверхностных и сточных вод производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
Пробы воды, объемом не менее 500 см3, отбирают в бутыли из полимерного материала или стекла, предварительно ополоснутые отбираемой водой.
Пробу воды анализируют в день отбора, не консервируют.
При отборе проб составляют сопроводительный документ, в котором указывают:
цель анализа, предполагаемые загрязнители;
место, время отбора;
номер пробы;
объем пробы;
должность, фамилия отбирающего пробу, дата.
8.3 Подготовка фарфоровых чашек
Пустые пронумерованные чашки выдерживают в сушильном шкафу при температуре 105 ± 2 °С до постоянной массы, охлаждают в эксикаторе, взвешивают.
Общая минерализация: понятие и категории
Под общей минерализацией принято понимать суммарное содержание веществ, растворённых в воде, что обуславливает и второе название «солесодержание», которое тоже правомерно применять, так как растворённые вещества находятся в воде в виде солей калия, магния, натрия, сульфатов кальция, хлоридов, гидрокарбонатов. В основном это неорганические вещества и в небольшом количестве органические.
Поверхностные воды, при прочих равных, в оценке солесодержания имеют меньший осадок, чем подземные. Поэтому подземные имеют более солоноватый (иногда – горьковатый) привкус. Кроме того, на степень минерализации влияют:
- геологический регион,
- сточные воды (особенно в промышленных регионах),
- ливневые стоки преимущественно в тех городах, где с обледенением коммунальные службы повсеместно используют соль.
Для облегчения градации минерализации («солёности») природной воды используется таблица категорий от ультрапресных до рассолов:

Санитарные нормы
Существуют определенные нормативы, которым должна соответствовать вода. Если содержание сухого остатка им не удовлетворяет, в таком случае ее нельзя использовать. Существуют специальные физико-химические лаборатории, которые оснащены специальными измерительными приборами.
В них массовая доля сухого остатка определяется по ГОСТу «Вода питьевая» 18164-72. Используют воду в производстве лишь после того, как будет проведен полный контроль ее на соответствие всем показателям качества.
Если в ходе исследований будут выявлены несоответствия по каким-либо показателям, необходимо составить протокол о несоответствии, выполняют необходимые корректирующие мероприятия.

Хлориды
Хлориды определяют совокупность находящегося в теле хлора, который способствует поддержанию кислотно-щелочного баланса жидкостей и играет важную роль при производстве соляной кислоты в желудке.
Хлор
Хлором обеззараживают воду, т.к. хлор — мощный окислитель, способный уничтожать болезнетворные микроорганизмы. Однако в реках и озерах, откуда ведется водозабор, присутствует множество веществ, попавших туда со сточными водами, и с некоторыми из них хлор вступает в реакцию. В результате образуются гораздо более токсические соединения, чем сам хлор. Например, соединения хлора с фенолом; они придают воде неприятный запах, влияют на печень и почки, но в малых концентрациях не очень опасны. Однако возможны соединения хлора с бензолом, толуолом, бензином, с образованием диоксина, хлороформа, хлортолуола и других канцерогенных веществ. Обеззараживать воду без хлора экономически нецелесообразно, поскольку альтернативные методы обеззараживания воды, связанные с использованием газообразного озона, ултрафиолета и серебра для этой цели дорогие.
11.2 Вычисление содержания прокаленного остатка
11.2.1 Вычисление массовой
концентрации прокаленного остатка, X, мг/дм3, производят по
формуле
|
(4) |
где m3
— масса выпарительной чашки с прокаленным остатком, г;
m2 — масса пустой
выпарительной чашки, г;
Vпробы — объем фильтрата пробы, взятый для
анализа, см3.
11.2.2 Вычисление массовой
концентрации прокаленного остатка, X, млн-1, производят по
формуле
|
(5) |
где m3
— масса выпарительной чашки (бюкса) с прокаленным остатком, г;
m2 — масса пустой
выпарительной чашки (бюкса), г;
Vпробы — объем фильтрата пробы, взятый для
анализа, см3;
— объем дистиллированной воды,
добавленный для доведения влажности пробы до ≥ 90 % по , см3.
m3∙(1 — W) — масса сухого
вещества пробы осадка, шлама, активного ила, отходов, донного отложения,
взятого для анализа (с учетом влажности анализируемой пробы W, в долях
единицы, по п. ).
11.3 Результат анализа в
документах, предусматривающих его исполнение, представляют в виде
X
± 0,01∙δ∙X, при Р = 0,95
где ±δ — границы
относительной погрешности измерений, % (таблица ).
Если полученный результат анализа ниже нижней (выше верхней)
границы диапазона измерений, то производят следующую запись в журнале;
«содержание остатка менее 5,0 мг/дм3 (млн-1) (более 50000
мг/дм3 (млн-1))».
12
ПРОВЕРКА ПРИЕМЛЕМОСТИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ, ПОЛУЧЕННЫХ В УСЛОВИЯХ
ВОСПРОИЗВОДИМОСТИ
Проверку приемлемости результатов измерений в условиях
воспроизводимости проводят:
а) при возникновении спорных ситуаций между двумя
лабораториями;
б) при проверке совместимости результатов измерений,
полученных при сличительных испытаниях (при проведении аккредитации
лабораторий, при проведении процедур подтверждении компетентности
аккредитованных лабораторий, при арбитражных измерениях).
Для проведения проверки приемлемости результатов измерений в
условиях воспроизводимости каждая лаборатория использует пробы, оставленные на
хранение (резервные пробы).
Приемлемость результатов
измерений, полученных в двух лабораториях, оценивают сравнением разности этих
результатов с пределом воспроизводимости, R, по формуле
|
|X1 — Х2| ≤ R |
(1) |
где X1, X2 — значение
остатка, полученные в первой и второй лабораториях, мг/дм3 (млн-1);
|
R |
(2) |
где σR —
показатель воспроизводимости, (таблица ).
Если предел воспроизводимости не превышен, то приемлемы оба
результата измерений, проводимых двумя лабораториями, и в качестве
окончательного результата используют их среднее арифметическое значение. Если
предел воспроизводимости превышен, то выполняют процедуры, изложенные в ГОСТ
Р ИСО 5725-6-2002 (5.3.3).
При разногласиях руководствуются ГОСТ
Р ИСО 5725-6-2002 (5.3.4).
13
КОНТРОЛЬ КАЧЕСТВА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ ПРИ РЕАЛИЗАЦИИ МЕТОДИКИ В ЛАБОРАТОРИИ
Контроль качества результатов измерений в лаборатории при
реализации методики осуществляют по ГОСТ
Р ИСО 5725-6, используя контроль стабильности среднеквадратического
(стандартного) отклонения промежуточной прецизионности, установленной в
лаборатории по п. 6.2.3 ГОСТ
Р ИСО 5725-6. Проверку стабильности осуществляют с применением контрольных
карт Шухарта.
Периодичность контроля стабильности результатов выполнения измерений
регламентируют в Руководстве по качеству лаборатории.
Рекомендуется устанавливать контролируемый период так, чтобы
количество результатов контрольных измерений было от 20 до 30.
При неудовлетворительных результатах контроля, например, при
превышении предела действия или регулярном превышении предела предупреждения,
выясняют причины этих отклонений, в том числе проводят смену реактивов,
проверяют используемое оборудование и работу оператора.
Вкусовые признаки и обеспечение минералами организма через воду
Порог ощущений для сульфатов находится на уровне 500 мг/литр, а для хлоридов – на уровне 350 мг/литр. В целом приемлемой на вкус считается вода с общим солесодержанием на уровне 600 мг/литр.
Вкусовые качества низкоминерализированной воды определяются в зависимости от вкусовых привычек потребителей и характеризуются в диапазоне от «пресная и невкусная» до «лёгкая и приятная».
При этом существует объективный нижний предел минерализации, основанный на адаптивных реакциях гомеостаза организма, который находится на отметке 100 мг сухого остатка на литр с показателями 25 и 10 мг/л для кальция и магния соответственно. Оптимальным же в целом считается среднее значение в пределах 200-400 мг сухого остатка на литр.
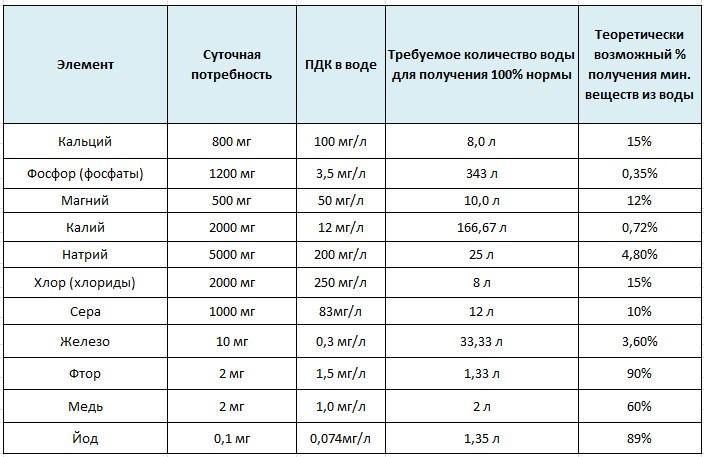
Возможность снабжения минеральными веществами организма через воду в объёме четверти от необходимой суточной потребности активно оспаривается противниками этой тенденции. В качестве доказательства приводятся убедительные сводные таблицы, в которых сопоставляется ряд признаков:
- Необходимые человеку минералы (с условным завышенным допущением полной усвояемости веществ).
- Состав при условии содержания максимально допустимых концентраций.
- Суточное водопотребление и др.
В совокупности эти признаки демонстрируют, что в качестве источника микроэлементов вода может теоретически рассматриваться только для обеспечения организма фтором и йодом. Однако с учётом целого ряда условных «идеальных» допущений и разницы содержания таких элементов в разных регионах России, нельзя рассматривать питьевую воду как достаточный источник поступления даже этих микроэлементов.