Гост 5789-78 реактивы. толуол. технические условия (с изменениями n 1, 2, с поправкой)
Содержание:
- Токсичность и опасность
- Экология
- Таблица плотности водных растворов кислот и щелочей при 20°C
- Клиническая информация, средства защиты, первоочередные действия в очаге
- Применение бензола
- Профессиональные вредности
- Пожарная опасность
- Химические свойства
- Ряд бензола
- Примечания
- Опасность для здоровья
- Краткое описание химических свойств и плотность толуола
- Токсичность толуола
- Что такое бензол
- Таблица плотности растворителей при различной температуре
- Заключение
Токсичность и опасность
Аварийные гигиенические регламенты и референтные уровни
| Аварийные референтные
концентрации (мг/м³) |
|
||||||||||||||||||||
| Аварийные пределы воздействия
отравляющих веществ в воздухе (АПВ, мг/м³) |
|
||||||||||||||||||||
| Референтные концентрации для
хронического ингаляционного |
0,4 | ||||||||||||||||||||
| Поражаемые органы и системы | органы дыхания, ЦНС | ||||||||||||||||||||
| Субъективная реакция дискомфорта (мг/м³) |
2,07 |
Опасность при утечке
Вещество может всасываться в организм при вдыхании, через кожу и через рот. Опасное загрязнение воздуха будет достигаться довольно быстро при испарении этого вещества при 20°C. Вещество раздражает глаза и дыхательные пути. Воздействие может вызвать депрессию центральной нервной системы. Воздействие в большой дозе может вызвать сердечную дисритмию, потерю сознания и смерть. Реагирует бурно с сильными окислителями с опасностью пожара и взрыва.
Острая токсичность
| Токсичность для животных |
|
||||||||||
|
Токсичность для человека |
| Тип дозы | Способ измерения | Механизм воздействия | Состояние человека | Значение |
|---|---|---|---|---|
|
Наименьшая опубликованная смертельная доза (LCLo, LDLo) |
в целом на организм | перорально | в состоянии покоя | 50 мг/кг |
| Наименьшая опубликованная токсичная доза (TCLo, TDLo) | в целом на организм | ингаляционно | в состоянии покоя | 752 мг/м3 |
|
Смертельная доза (LC100, LD100) |
в целом на организм | перорально | в состоянии покоя | 60 мл |
| Мгновенно-опасная для жизни или здоровья концентрация (IDLH) | в целом на организм | ингаляционно | в состоянии покоя | 1881 мг/м3 |
| Пороговая токсодоза (PCt50, мг.мин/л) | 120 |
| Смертельная токсодоза (LCt50, мг.мин/л) | 900 |
Экология
Бензол экологически небезопасное вещество, токсикант антропогенного происхождения. Основными источниками бензола, поступающего в окружающую среду со сточными водами или выбросами в атмосферу, являются нефтехимические и коксохимические промышленные предприятия, производство топлива и транспорт.
Из водоёмов бензол легко улетучивается, cпособен к трансформации из почв в растения, что несёт серьёзную угрозу экосистемам.
Бензол обладает свойством кумуляции, вследствие своей липофильности он способен депонироваться в клетках жировой ткани животных, тем самым отравляя их.
Таблица плотности водных растворов кислот и щелочей при 20°C
Приведены плотности водных растворов (г/см3) при 20°C для следующих веществ: серная кислота, азотная кислота, соляная кислота, гидроксид калия, гидроксид натрия, аммиак
|
Массовая |
Серная кислота |
азотная кислота |
Соляная кислота |
Гидроксид калия |
Гидроксид натрия |
Аммиак |
|---|---|---|---|---|---|---|
|
2 |
1.0116 |
1.0091 |
1.0081 |
1.0155 |
1.0207 |
0.9855 |
|
4 |
1.0250 |
1.0202 |
1.0179 |
1.0330 |
1.0428 |
0.9811 |
|
6 |
1.0385 |
1.0314 |
1.0278 |
1.0509 |
1.0648 |
0.9730 |
|
8 |
1.0522 |
1.0427 |
1.0377 |
1.0690 |
1.0869 |
0.9651 |
|
10 |
1.0661 |
1.0543 |
1.0476 |
1.0873 |
1.1089 |
0.9575 |
|
12 |
1.0802 |
1.0660 |
1.0576 |
1.1059 |
1.1309 |
0.9502 |
|
14 |
1.0947 |
1.0780 |
1.0676 |
1.1246 |
1.1530 |
0.9431 |
|
16 |
1.1094 |
1.0901 |
1.0777 |
1.1435 |
1.1751 |
0.9361 |
|
18 |
1.1245 |
1.1025 |
1.0878 |
1.1626 |
1.1971 |
0.9294 |
|
20 |
1.1398 |
1.1150 |
1.0980 |
1.1818 |
1.2192 |
0.9228 |
|
22 |
1.1554 |
1.1277 |
1.1083 |
1.2014 |
1.2412 |
0.9164 |
|
24 |
1.1714 |
1.1406 |
1.1185 |
1.2210 |
1.2631 |
0.9102 |
|
26 |
1.1872 |
1.1536 |
1.1288 |
1.2408 |
1.2848 |
0.9040 |
|
28 |
1.2031 |
1.1668 |
1.1391 |
1.2609 |
1.3064 |
0.8980 |
|
30 |
1.2191 |
1.1801 |
1.1492 |
1.2813 |
1.3277 |
0.8920 |
|
32 |
1.2353 |
1.1934 |
1.1594 |
1.302 |
1.3488 |
0.8863 |
|
34 |
1.2518 |
1.2068 |
1.1693 |
1.324 |
1.3697 |
0.8809 |
|
36 |
1.2685 |
1.2022 |
1.1791 |
1.346 |
1.3901 |
|
|
38 |
1.2855 |
1.2335 |
1.1886 |
1.367 |
1.4102 |
|
|
40 |
1.3028 |
1.2466 |
1.1977 |
1.3881 |
1.4299 |
|
|
42 |
1.3205 |
1.259 |
1.410 |
1.449 |
||
|
44 |
1.3386 |
1.272 |
1.433 |
1.468 |
||
|
46 |
1.3570 |
1.285 |
1.456 |
1.487 |
||
|
48 |
1.3759 |
1.297 |
1.479 |
1.506 |
||
|
50 |
1.3952 |
1.310 |
1.5024 |
1.525 |
||
|
52 |
1.4149 |
1.322 |
||||
|
54 |
1.4351 |
1.333 |
||||
|
56 |
1.4558 |
1.345 |
||||
|
58 |
1.4770 |
1.356 |
||||
|
60 |
1.4987 |
1.367 |
||||
|
62 |
1.520 |
1.377 |
||||
|
64 |
1.542 |
1.386 |
||||
|
66 |
1.565 |
1.396 |
||||
|
68 |
1.587 |
1.405 |
||||
|
70 |
1.6105 |
1.413 |
||||
|
72 |
1.634 |
1.422 |
||||
|
74 |
1.657 |
1.430 |
||||
|
76 |
1.681 |
1.437 |
||||
|
78 |
1.704 |
1.445 |
||||
|
80 |
1.7272 |
1.452 |
||||
|
82 |
1.749 |
1.459 |
||||
|
84 |
1.769 |
1.465 |
||||
|
88 |
1.802 |
1.477 |
||||
|
90 |
1.8144 |
1.482 |
||||
|
92 |
1.8240 |
1.487 |
||||
|
94 |
1.8312 |
1.409 |
||||
|
96 |
1.8355 |
1.497 |
||||
|
98 |
1.8361 |
1.505 |
||||
|
100 |
1.8305 |
1.513 |
Органические кислоты
| Массовая доля,% |
Муравьиная кислота |
Уксусная кислота |
Трихлоруксусная кислота |
Молочная кислота |
Лимонная кислота |
|---|---|---|---|---|---|
|
0.5 |
0.9994 |
0.9989 |
1.0008 |
0.9992 |
1.0002 |
|
1.0 |
1.0006 |
0.9996 |
1.0034 |
1.0002 |
1.0022 |
|
2.0 |
1.0029 |
1.0011 |
1.0083 |
1.0023 |
1.0063 |
|
3.0 |
1.0053 |
1.0025 |
1.0133 |
1.0043 |
1.0105 |
|
4.0 |
1.0077 |
1.0038 |
1.0182 |
1.0065 |
1.0147 |
|
5.0 |
1.0102 |
1.0052 |
1.0230 |
1.0086 |
1.0189 |
|
6.0 |
1.0126 |
1.0066 |
1.0279 |
1.0108 |
1.0232 |
|
7.0 |
1.0150 |
1.0080 |
1.0328 |
1.0131 |
1.0274 |
|
8.0 |
1.0175 |
1.0093 |
1.0378 |
1.0153 |
1.0316 |
|
9.0 |
1.0199 |
1.0107 |
1.0428 |
1.0176 |
1.0359 |
|
10.0 |
1.0224 |
1.0121 |
1.0479 |
1.0199 |
1.0402 |
|
12.0 |
1.0273 |
1.0147 |
1.0583 |
1.0246 |
1.0490 |
Клиническая информация, средства защиты, первоочередные действия в очаге
| Общий характер действия |
|
Средства защиты
Для химразведки и руководителя работ — ПДУ-3 (в течение 20 мин). Для аварийных бригад — изолирующий защитный костюм КИХ-5 в комплекте с изолирующим противогазом ИП-4М или дыхательным аппаратом АСВ-2. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20. При отсутствии указанных образцов: защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом марки РПГ и патронами А, БКФ. При малых концентрациях в воздухе (при повышении ПДК до 100 раз) — спецодежда, промышленный противогаз малого габарита ПФМ-1 с универсальным защитным патроном ПЗУ, автономный защитный индивидуальный комплект с принудительной подачей в зону дыхания очищенного воздуха. Маслобензостойкие перчатки, перчатки из дисперсии бутилкаучука, специальная обувь.
Химический очаг
Вид очага
Нестойкий, быстродействующий. Пар тяжелее воздуха и может стелиться по земле; возможно возгорание на расстоянии. В результате вытекания, перемешивания и др. могут образоваться электростатические заряды. Пары скапливаются в нижних этажах зданий, подвалах, низинах, оврагах.
Первоочередные мероприятия
Проведение поисково-спасательных работ в очаге, в том числе оказание первой медицинской помощи пострадавшим и их вынос (вывоз) на временные пункты сбора в оптимальные для спасения жизни и сохранения здоровья сроки, ведение разведки, обозначение и оцепление очага. Изолировать опасную зону в радиусе не менее 200 м. Откорректировать указанное расстояние по результатам химразведки. Держаться наветренной стороны. Избегать низких мест. Соблюдать меры пожарной безопасности. В опасную зону входить в защитных средствах. Не прикасаться к пролитому веществу
Устранить течь с соблюдением мер предосторожности. Проливы оградить земляным валом
Не допускать попадания вещества в водоемы, подвалы, канализацию. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить тонкораспыленной водой, воздушно-механической и химической пенами с максимального расстояния.
Применение бензола
Ранее этот углеводород использовался в составе бензина, а также в качестве растворителя смол, красок, лака. Сейчас он является исходным реагентом для синтеза многих других продуктов.
Бензол применяется в химической и полиграфической промышленности. Он входит в состав:
- некоторых видов пластмасс;
- моторного топлива;
- анилиновых красителей;
- моющих средств;
- взрывчатых веществ;
- синтетического каучука;
- растворителей.
Находит бензол применение и в медицине. Большая группа лекарственных средств содержит вещества, синтезированные на его основе. К ней относятся некоторые отхаркивающие, жаропонижающие, противосудорожные средства, местные анестетики, препараты для лечения заболеваний кожи.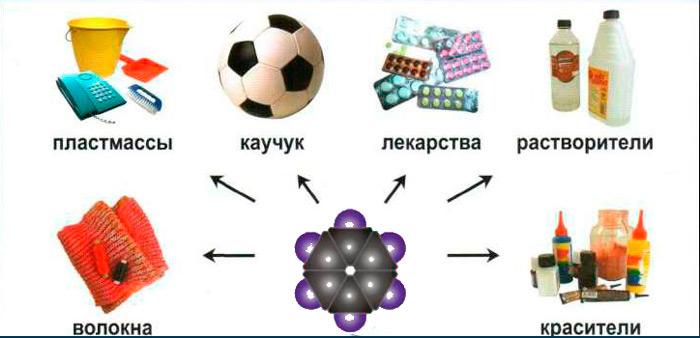
Профессиональные вредности
Толуол, как и другие ароматические углеводороды (см.), применяется в промышленности в качестве органического растворителя (см. Растворители). В организм контактирующих с ним он может попадать через органы дыхания, частично — через неповрежденную кожу. Высокая растворимость Т. в жирах и липидах способствует его накоплению в клетках ц. н. с., что определяет нек-рое наркотическое действие Т. Способность Т. изменять свойства биол. мембран (см. Мембраны биологические) также объясняется его высокой растворимостью в липидах. Это свойство Т. лежит в основе патогенеза проф. патологии, отмечаемой при интоксикациях Т.
Хрон. интоксикации Т. в производственных условиях наблюдают редко. При этом в клин, картине преобладают изменения системы крови с активацией процессов эритропоэза и тромбоцитопоэза. В крови отмечают тенденцию к эритроцитопении и ретикулоцитозу, связанную с сокращением продолжительности жизни эритроцитов, цитоплазматическая мембрана к-рых повреждается Т. У женщин при продолжительном (10—15 лет) контакте с Т. возможно развитие умеренной железодефицитной анемии, нередко сочетающейся с патологией половых органов. Прекращение контакта с Т. и своевременная терапия приводят к нормализации картины крови, что подтверждает роль профессионального фактора в ее патол. изменении. Наблюдаемые нарушения со стороны нервной системы характеризуются симптомами астеновегетативного или астеноневротического синдрома (см. Астенический синдром). Как правило, они мало выражены и сочетаются с другими проявлениями интоксикации. Изменения кожи при контакте с Т. чаще всего носят характер дерматита в виде сухости и трещин кожи. В редких случаях развивается контактная экзема (см.) или меланоз (см.).
Лечение при хрон. интоксикациях Т. симптоматическое.
Острые интоксикации Т. наблюдают лишь в аварийных ситуациях. Клин, проявлениями острого отравления Т. являются эйфория, головная боль, тошнота, рвота.
Первая помощь и неотложная терапия при остром отравлении Т. заключаются в немедленном прекращении контакта пострадавшего с Т.— пострадавшего необходимо вынести или вывести на свежий воздух, обеспечить ему покой, тепло, дать сердечные и успокаивающие средства (бромиды, препараты валерианы). Применение адреналина и адреномиметиков противопоказано. Дальнейшее лечение — симптоматическое. Госпитализация требуется редко.
Вопросы экспертизы трудоспособности, медицинской и трудовой реабилитации при интоксикациях Т. решаются с учетом выраженности клин, симптомов интоксикации и гиг. характеристики условий труда (см. Экспертиза).
Меры профилактики отравления Т.: обеспечение герметизации оборудования на соответствующих производствах и приточно-вытяжной вентиляции (см.) производственных помещений, контроль воздушной среды, использование противогазов (см.), спецодежды (см. Одежда специальная), соблюдение мер личной гигиены, проведение периодических мед. осмотров (см. Медицинский осмотр) 1 раз в 12 мес.
Предельно допустимая концентрация паров Т. 50 мг/м3.
Библиогр.: Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 1, с. 98, Л., 1976; Грибова И. А. и др. Состояние системы крови у рабочих, имеющих контакт с толуолом, Гиг. труда и проф. заболев., JNS 10, с. 6, 1975; Каррер П. Курс органической химии, пер. с англ., Л., 1960; Руководство по профессиональным заболеваниям, под ред. Н. Ф. Измерова, т. 1, М., 1983; Соколов В. В. и др. Структурно-функциональные особенности мембран эритроцитов при воздействии толуола, Гиг. труда и проф. заболев., № 1, с. 27, 1981; Хаген И. Клиника профессиональных заболеваний, пер. с нем., Л., 1961.
Пожарная опасность
Нельзя не упомянуть и о ней, рассказывая про химические и физические свойства толуола. Ведь это очень огнеопасное вещество.
Оно относится к классу 3,1 легковоспламеняющихся жидкостей. В эту же категорию входит дизельное топливо, газойль, десенсибилизированные взрывчатые соединения.
Нельзя допускать возникновения рядом с толуолом открытого огня, курения, искр. Даже смесь паров этого вещества с воздухом является взрывоопасной
Если выполняются сливно-наливные операции, то соблюдение правил защиты от статического электричества приобретает первостепенную важность
Производственные помещения, предназначенные для проведения работ, связанных с толуолом, обеспечиваются приточно-вытяжной вентиляцией, а техника – отсосами. Запрещен использование инструментов, которые могут при ударе дать искру. А если происходит возгорание вещества, то тушить его нужно лишь тонкораспыленной водой, воздушно-механической или химической пеной. Разлитый толуол обезвреживают песком.
Химические свойства
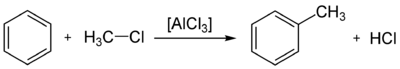
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
-
- C6H6+H2C=CH2→AlCl3∗HClC6H5CH2CH3{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}C=CH_{2}{\xrightarrow{AlCl_{3}*HCl}}C_{6}H_{5}CH_{2}CH_{3}}}}
-
- C6H6+CH2=CH−CH3→AlCl3∗HClC6H5CH(CH3)2{\displaystyle {\mathsf {C_{6}H_{6}+CH_{2}=CH-CH_{3}{\xrightarrow{AlCl_{3}*HCl}}C_{6}H_{5}CH(CH_{3})_{2}}}}
Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
-
- C6H6+Cl2→FeCl3C6H5Cl+HCl{\displaystyle {\mathsf {C_{6}H_{6}+Cl_{2}{\xrightarrow{FeCl_{3}}}C_{6}H_{5}Cl+HCl}}}
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
-
- C6H6+3Cl2→T,hνC6H6Cl6{\displaystyle {\mathsf {C_{6}H_{6}+3Cl_{2}{\xrightarrow{T,h\nu }}C_{6}H_{6}Cl_{6}}}}
При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
-
- C6H6+6Br2→H2SO4∗SO3C6Br6+6HBr{\displaystyle {\mathsf {C_{6}H_{6}+6Br_{2}{\xrightarrow{H_{2}SO_{4}*SO_{3}}}C_{6}Br_{6}+6HBr}}}
Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
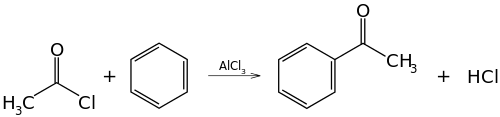
Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
-
- C6H6+(CH3CO)2O→AlCl3C6H5COCH3+CH3COOH{\displaystyle {\mathsf {C_{6}H_{6}+(CH_{3}CO)_{2}O{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COCH_{3}+CH_{3}COOH}}}
-
- C6H6+C6H5COCl→AlCl3C6H5COC6H5+HCl{\displaystyle {\mathsf {C_{6}H_{6}+C_{6}H_{5}COCl{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COC_{6}H_{5}+HCl}}}
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С.
В третьей реакции образуется бензофенон (дифенилкетон).
Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
-
- C6H6+CO+HCl→AlCl3C6H5COH+HCl{\displaystyle {\mathsf {C_{6}H_{6}+CO+HCl{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COH+HCl}}}
Реакции сульфирования и нитрования (электрофильное замещение):
-
- C6H6+HNO3→H2SO4C6H5NO2+H2O{\displaystyle {\mathsf {C_{6}H_{6}+HNO_{3}{\xrightarrow{H_{2}SO_{4}}}C_{6}H_{5}NO_{2}+H_{2}O}}}
-
- C6H6+H2SO4→C6H5SO3H+H2O{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}SO_{4}\rightarrow C_{6}H_{5}SO_{3}H+H_{2}O}}}
Восстановление бензола водородом (каталитическое гидрирование):
-
- C6H6+3H2→NiPd,Pt;tC6H12{\displaystyle {\mathsf {C_{6}H_{6}+3H_{2}{\xrightarrow{Ni/Pd,Pt;t}}C_{6}H_{12}}}}
Реакции окисления
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
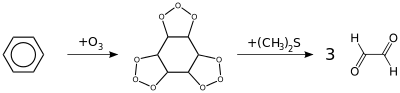
Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем (содержит до 92% углерода в молекуле):
-
- 2C6H6+15O2→12CO2+6H2O{\displaystyle {\mathsf {2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}+6H_{2}O}}}
Ряд бензола
Формула бензола – С6Н6. Это бесцветная жидкость со сладковатым запахом. Бензол входит в состав бензина и используется для изготовления лекарств, пластмасс, искусственного каучука, красителей. Является токсичным веществом.
Основа молекулы бензола – бензольное кольцо, которое образуют шесть атомов углерода, соединённых σ-связями. К каждому атому углерода присоединён посредством простой связи водород. Прочную связь между атомами углерода обозначают кругом внутри шестиугольника.
Рис. 1. Структурная формула бензола
Гомологи отличаются друг от друга одной группой -СН2. Общая молекулярная формула гомологов бензола – CnH2n-6. Наименования гомологов соответствуют наименованиям алканов с суффиксом «-ил» и словом «бензол». Также широко используются тривиальные названия с суффиксом «-ол».
Примеры нескольких представителей ряда бензола описаны в таблице.
|
Гомолог |
Формула |
Физические свойства |
|
Метилбензол (толуол) |
C7H8 |
Бесцветная горючая жидкость, проявляющая слабое наркотическое действие. Смешивает с углеводородами, спиртами, эфирами в неограниченном количестве, но не смешивается с водой |
|
Этилбензол |
C8H10 |
Бесцветная токсичная жидкость с запахом бензина. Растворяется в спирте, бензоле, эфире, CCl4 |
|
Пропилбензол |
C9H12 |
Бесцветная горючая жидкость с резким запахом. Хорошо смешивается с органическими растворителями, не растворим в воде |
|
Бутилбензол (дурол) |
C10H14 |
Бесцветное летучее кристаллическое вещество с запахом камфоры. Плохо растворяется в уксусной кислоте, легко растворяется в бензоле, эфире, спирте |
К бензольному кольцу могут присоединяться не только предельные углеводородные радикалы. Например, стирол или винилбензол состоит из бензольного кольца, к которому присоединён ненасыщенный углеводородный радикал -СН=СН2. Наличие бензольного кольца указывает, что стирол – ароматический углеводород. Однако из-за наличия двойной связи и несоответствия формуле CnH2n-6 стирол нельзя отнести к гомологическому ряду бензола.
Рис. 2. Структурная формула стирола
Бензол впервые выделил Майкл Фарадей в 1825 году из коксового (светильного) газа, представляющего собой смесь метана, водорода и угарного газа.
Примечания
- ↑ Introduction to Chemical Engineering Thermodynamics (англ.) // J. Chem. Educ.
- ↑
- ↑
- Helmut Fiege, P.J. Garratt, Christ. J. Grundmann, Gundermann, Wolfgang Loeser, Peter Müller, Heidi Müller-Dolezal, Peter L. Pauson, Renate Stoltz, Hanna Söll, M. Zander Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes, Издание четвёртое, Georg Thieme Verlag, 2014, ISBN 3131799749, 9783131799746
- Kasper, Dennis L.et al. (2004) Harrison’s Principles of Internal Medicine, 16th ed., McGraw-Hill Professional, p. 618, ISBN 0071402357.
- Розенцвит Г. Э. Клиника профессиональных нейротоксикозов. Л,, 1964, 18 с.
- Кушелев В. П., Орлов Г. Г., Сорокин Ю. Г. Охрана труда в нефтеперерабатывающей и нефтехимической промышленности. — М.: Химия, 1983. — С. 42. — 472 с.
Опасность для здоровья
Толуол опасен не только для здоровья человека, но и для окружающей среды. Проникает вещество в организм через поры кожи и дыхательные пути. Длительное воздействие и накопление вредного вещества может вызвать серьезные заболевания нервной системы, например, энцефалопатию. Также пагубно толуол, как и подобные ароматические углеводороды, пагубно влияет на кровь и кроветворные органы.
Признаки отравления толуолом: тошнота, головокружение, нарушение равновесия, приторможенность сознания и реакций. Длительное и сильное отравление может привести к необратимым последствиям и летальному исходу. Толуол является легковоспламенимым веществом.
Правила работы с толуолом:
- использовать резиновые перчатки,
- постоянно проветривать помещение,
- не вдыхать пары,
- не использовать открытый огонь в местах работы,
- хранить в плотно закрытой таре вдали от источников тепла.
ОПРЕДЕЛЕНИЕ
Толуол (метилбензол)
— химическое соединение органической природы, представитель класса ароматических углеводородов, ближайший гомолог бензола. Толуол — бесцветная жидкость, нерастворимая в воде.
Горюч, сгорает коптящим пламенем. Обладает резким запахом, а также слабовыраженным наркотическим действием. Основные физические константы толуола приведены в табл. 1. Применяется в производстве взрывчатых веществ, бензойной кислоты, сахарина, лаков, типографских красок. Он употребляется в качестве добавки к моторному топливу как компонент высокооктановых бензинов.
Таблица 1. Физические свойства и плотность толуола.
Толуол на два порядка менее токсичен, чем бензол, вследствие того что окисляется в бензойную кислоту и экскретируется из организма. Во всех случаях, где это возможно, следует производить замену бензола на толуол.
Краткое описание химических свойств и плотность толуола
Для толуола, как и для всех ароматических углеводородов характерны реакции замещения в бензольном кольце, которые протекают по электрофильному механизму. За счет наличия в составе толуола радикала метила, замещение атомов водорода чаще всего происходит в орто- или пара-положении:
Галогенирование (толуол взаимодействует с хлором и бромом в присутствии катализаторов — безводных AlCl 3 , FeCl 3 , AlBr 3)
C 6 H 5 -CH 3 + Cl 2 = C 6 H 4 Cl-CH 3 + HCl;
— нитрование (толуол легко реагирует с нитрующей смесью — смесь концентрированных азотной и серной кислот)
— алкилирование по Фридею-Крафтсу
C 6 H 5 -CH 3 + CH 3 -CH(CH 3)-Cl = CH 3 -C 6 H 4 -CH(CH 3)-CH 3 + HCl.
Реакции присоединения к толуолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор — Pt)
C 6 H 5 -CH 3 + 3H 2 = C 6 H 11 -CH 3 .
В результате окисления толуола образуется бензойная кислота:
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O;
Реакция взаимодействия толуола с хлором на свету приводит к замещению в углеводородном радикале:
C 6 H 5 -CH 3 + Cl 2 = C 6 H 5 -CH 2 Cl + HCl.
Токсичность толуола
Метилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
- раздражение глаз и нарушение цветового зрения;
- длительное воздействие может привести к потере слуха;
- высокая концентрация в крови вызывает поражение печени, некроз почек;
- вдыхание большого количества паров приводит к головокружению, сонливости, головной боли.
Что такое бензол
Это органическое вещество, прозрачная жидкость со сладковатым запахом. По химической структуре относится к простейшим ароматическим углеводородам.
Основные естественные источники бензола в природе — каменный уголь и нефть. В лабораторных условиях возможна его полимеризация (образование) из ацетилена. Промышленные способы получения бензола — коксование из каменного угля, а также каталитический риформинг и пиролиз бензиновых фракций нефти.
Химическая формула бензола — C6H6. Это циклическая структура из шести атомов углерода была открыта в 1865 году немецким химиком Фридрихом Августом Кекуле. А впервые в чистом виде бензол был обнаружен ещё раньше — в 1825 г. английский физик Фарадей выделил его светильного газа.
Физические свойства бензола включают плохую растворимость в воде, смешиваемость с органическими растворителями, высокую степень воспламеняемости, горючесть, взрывоопасность. Его расплавление происходит при температуре 5,5–6,0 °C, испарение при 79,6–80,5 °C, кипение — 80,1 °C. Он легче воды, так как имеет низкую относительную плотность (0,88 г/см3). Является легкорастворимым в эфире и спирте веществом.
Химические свойства бензола обусловлены его принадлежностью к группе ненасыщенных углеводородов с циклической структурой. Поэтому ему типичны реакции окисления и замещения. Методика промышленной разработки была предложена немецким учёным Гофманом, выделившим вещество из каменноугольной смолы.
Бензол сильно ядовит. Токсическое действие происходит:
- ингаляционно — при вдыхании паров;
- трансдермально — при непосредственном контакте с кожей или слизистыми оболочками;
- перорально — при ошибочном употреблении жидкости внутрь.
Многие интересные факты о бензоле, связанные с изучением его структуры и свойств, сохранились и дошли до наших дней. Так, немецкий учёный Гофман, читая лекции студентам о физических свойствах углеводородов, всегда цитировал слова знакомой ему дамы, что запах бензола такой же, как у стираных перчаток. А идея кольцевой структуры бензола якобы пришла к химику Кекуле во сне — змея, состоящая из шести атомов углерода, свернулась в кольцо и укусила себя за хвост.
Что такое бензол — видеоурок
Таблица плотности растворителей при различной температуре
Приведены значения плотности (г/см3) наиболее распространенных растворителей при различной температуре.
|
Растворитель |
Плотность, г/мл |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
0°C |
10°C |
20°C |
30°C |
40°C |
50°C |
60°C |
70°C |
80°C |
90°C |
100°C |
|
|
1-Бутанол |
0.8293 |
0.8200 |
0.8105 |
0.8009 |
0.7912 |
0.7812 |
0.7712 |
0.7609 |
0.7504 |
0.7398 |
0.7289 |
|
1-Гексанол |
0.8359 |
0.8278 |
0.8195 |
0.8111 |
0.8027 |
0.7941 |
0.7854 |
0.7766 |
0.7676 |
0.7585 |
0.7492 |
|
1-Деканол |
0.8294 |
0.8229 |
0.8162 |
0.8093 |
0.8024 |
0.7955 |
0.7884 |
0.7813 |
0.7740 |
||
|
1-Пропанол |
0.8252 |
0.8151 |
0.8048 |
0.7943 |
0.7837 |
0.7729 |
0.7619 |
0.7506 |
0.7391 |
0.7273 |
0.7152 |
|
2-Пропанол |
0.8092 |
0.7982 |
0.7869 |
0.7755 |
0.7638 |
0.7519 |
0.7397 |
0.7272 |
0.7143 |
0.7011 |
0.6876 |
|
N,N-Диметиланилин |
0.9638 |
0.9562 |
0.9483 |
0.9401 |
0.9318 |
0.9234 |
0.9150 |
0.9064 |
0.8978 |
0.8890 |
|
|
N-Метиланилин |
1.0010 |
0.9933 |
0.9859 |
0.9785 |
0.9709 |
0.9633 |
0.9556 |
0.9478 |
0.9399 |
0.9319 |
0.9239 |
|
Анилин |
1.041 |
1.033 |
1.025 |
1.016 |
1.008 |
1.000 |
0.9909 |
0.9823 |
0.9735 |
0.9646 |
0.9557 |
|
Ацетон |
0.8129 |
0.8016 |
0.7902 |
0.7785 |
0.7666 |
0.7545 |
0.7421 |
0.7293 |
0.7163 |
0.7029 |
0.6890 |
|
Ацетонитрил |
0.7825 |
0.7707 |
0.7591 |
0.7473 |
0.7353 |
0.7231 |
0.7106 |
0.6980 |
0.6851 |
||
|
Бензол |
0.8884 |
0.8786 |
0.8686 |
0.8584 |
0.8481 |
0.8376 |
0.8269 |
0.8160 |
0.8049 |
0.7935 |
|
|
Бутиламин |
0.7606 |
0.7512 |
0.7417 |
0.7320 |
0.7221 |
0.7120 |
0.7017 |
0.6911 |
0.6803 |
0.6693 |
0.6579 |
|
Гексан |
0.6774 |
0.6685 |
0.6594 |
0.6502 |
0.6407 |
0.6311 |
0.6212 |
0.6111 |
0.6006 |
0.5899 |
0.5789 |
|
Гептан |
0.7004 |
0.6921 |
0.6837 |
0.6751 |
0.6664 |
0.6575 |
0.6485 |
0.6393 |
0.6298 |
0.6202 |
0.6102 |
|
Декан |
0.7447 |
0.7374 |
0.7301 |
0.7226 |
0.7151 |
0.7074 |
0.6997 |
0.6919 |
0.6839 |
0.6758 |
0.6676 |
|
Дихлорметан |
1.362 |
1.344 |
1.326 |
1.307 |
1.289 |
1.269 |
1.250 |
1.229 |
1.208 |
1.187 |
1.165 |
|
Диэтиловый эфир |
0.7368 |
0.7254 |
0.7137 |
0.7018 |
0.6896 |
0.6770 |
0.6639 |
0.6505 |
0.6366 |
0.6220 |
0.6068 |
|
Изопропилбензол |
0.8769 |
0.8696 |
0.8615 |
0.8533 |
0.8450 |
0.8366 |
0.8280 |
0.8194 |
0.8106 |
0.8017 |
0.7927 |
|
Метанол |
0.8157 |
0.8042 |
0.7925 |
0.7807 |
0.7685 |
0.7562 |
0.7435 |
0.7306 |
0.7174 |
0.7038 |
0.6898 |
|
Метилацетат |
0.9606 |
0.9478 |
0.9346 |
0.9211 |
0.9074 |
0.8933 |
0.8790 |
0.8643 |
0.8491 |
0.8336 |
0.8176 |
|
Метилпропаноат |
0.9383 |
0.9268 |
0.9150 |
0.9030 |
0.8907 |
0.8783 |
0.8656 |
0.8526 |
0.8393 |
0.8257 |
0.8117 |
|
Метилформиат |
1.003 |
0.9887 |
0.9739 |
0.9588 |
0.9433 |
0.9275 |
0.9112 |
0.8945 |
0.8772 |
0.8594 |
0.8409 |
|
Метилциклогексан |
0.7858 |
0.7776 |
0.7693 |
0.7608 |
0.7522 |
0.7435 |
0.7346 |
0.7255 |
0.7163 |
0.7069 |
0.6973 |
|
м-Ксилол |
0.8813 |
0.8729 |
0.8644 |
0.8558 |
0.8470 |
0.8382 |
0.8292 |
0.8201 |
0.8109 |
0.8015 |
0.7920 |
|
Нитрометан |
1.139 |
1.125 |
1.111 |
1.097 |
1.083 |
1.069 |
1.055 |
1.040 |
1.026 |
||
|
Нонан |
0.7327 |
0.7252 |
0.7176 |
0.7099 |
0.7021 |
0.6941 |
0.6861 |
0.6779 |
0.6696 |
0.6611 |
0.6525 |
|
о-Ксилол |
0.8801 |
0.8717 |
0.8633 |
0.8547 |
0.8460 |
0.8372 |
0.8282 |
0.8191 |
0.8099 |
||
|
Октан |
0.7185 |
0.7106 |
0.7027 |
0.6945 |
0.6863 |
0.6779 |
0.6694 |
0.6608 |
0.6520 |
0.6430 |
0.6338 |
|
Пентановая кислота |
0.9563 |
0.9476 |
0.9389 |
0.9301 |
0.9211 |
0.9121 |
0.9029 |
0.8937 |
0.8843 |
0.8748 |
0.8652 |
|
п-Ксилол |
0.8609 |
0.8523 |
0.8436 |
0.8347 |
0.8258 |
0.8167 |
0.8075 |
0.7981 |
0.7886 |
||
|
Пропилацетат |
0.9101 |
0.8994 |
0.8885 |
0.8775 |
0.8662 |
0.8548 |
0.8432 |
0.8313 |
0.8192 |
0.8069 |
0.7942 |
|
Пропилбензол |
0.8779 |
0.8700 |
0.8619 |
0.8538 |
0.8456 |
0.8373 |
0.8289 |
0.8204 |
0.8117 |
0.8030 |
0.7943 |
|
Пропилформиат |
0.9275 |
0.9166 |
0.9053 |
0.8938 |
0.8821 |
0.8702 |
0.8581 |
0.8457 |
0.8330 |
0.8201 |
0.8068 |
|
Сероуглерод |
1.290 |
1.277 |
1.263 |
1.248 |
1.234 |
||||||
|
Тетрахлорметан |
1.629 |
1.611 |
1.593 |
1.575 |
1.557 |
1.538 |
1.518 |
1.499 |
1.479 |
1.458 |
1.437 |
|
Толуол |
0.8846 |
0.8757 |
0.8667 |
0.8576 |
0.8483 |
0.8389 |
0.8294 |
0.8197 |
0.8098 |
0.7998 |
0.7896 |
|
Уксусная кислота |
1.051 |
1.038 |
1.025 |
1.012 |
0.9993 |
0.9861 |
0.9728 |
0.9592 |
0.9454 |
||
|
Хлорбензол |
1.127 |
1.116 |
1.106 |
1.096 |
1.085 |
1.074 |
1.064 |
1.053 |
1.042 |
1.030 |
1.019 |
|
Хлороформ |
1.524 |
1.507 |
1.489 |
1.471 |
1.452 |
1.433 |
1.414 |
1.394 |
|||
|
Циклогексан |
0.7872 |
0.7784 |
0.7694 |
0.7602 |
0.7509 |
0.7414 |
0.7317 |
0.7218 |
0.7117 |
0.7013 |
|
|
Этанол |
0.8121 |
0.8014 |
0.7905 |
0.7793 |
0.7680 |
0.7564 |
0.7446 |
0.7324 |
0.7200 |
0.7073 |
0.6942 |
|
Этилацетат |
0.9245 |
0.9126 |
0.9006 |
0.8884 |
0.8759 |
0.8632 |
0.8503 |
0.8370 |
0.8234 |
0.8095 |
0.7952 |
|
Этилбензол |
0.8836 |
0.8753 |
0.8668 |
0.8582 |
0.8495 |
0.8407 |
0.8318 |
0.8228 |
0.8136 |
0.8043 |
0.7948 |
|
Этилпропаноат |
0.9113 |
0.9005 |
0.8895 |
0.8784 |
0.8671 |
0.8556 |
0.8439 |
0.8319 |
0.8197 |
0.8072 |
0.7944 |
|
Этилформиат |
0.9472 |
0.9346 |
0.9218 |
0.9087 |
0.8954 |
0.8818 |
0.8678 |
0.8535 |
0.8389 |
0.8238 |
0.8082 |
Заключение
Толуол в больших количествах производится на нефтехимических заводах или получается в качестве побочного продукта на коксовых предприятиях. Соединение является ценным сырьем для масштабного органического синтеза, используется в фармацевтической промышленности. Входит метилбензол в состав многих видов растворителей, которые применяются в работе с лакокрасочными материалами. Толуол относится в классификации ядовитых соединений к III классу опасности. При работе с веществом концентрация его паров в воздухе не должна превышать значений, которые определены санитарно-гигиеническими нормативами. Нельзя допускать при обращении с толуолом появления открытого огня, искр, это может привести к взрыву. Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
- при сжигании нефти, разных видов топлива;
- в действующих вулканах;
- в лесных пожарах;
- при использовании растворителей и красок.
Токсические свойства толуола, пожаро- и взрывоопасность требуют острожного обращения с жидким веществом и его парами.